Pakkausseloste
ENANTON DEPOT DUAL injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku 3,75 mg, 11,25 mg
Enanton Depot Dual 3,75 ja 11,25 mg injektiokuiva-aine ja liuotin suspensiota varten, esitäytetty ruisku
leuproreliiniasetaatti
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Enanton Depot Dual on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Enanton Depot Dual -valmistetta
- Miten Enanton Depot Dual -valmistetta käytetään
- Mahdolliset haittavaikutukset
- Enanton Depot Dual -valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Enanton Depot Dual on injektiovalmiste, joka sisältää leuproreliiniasetaattia. Leuproreliini on synteettinen hormoni, joka vähentää elimistön testosteroni- ja estrogeenipitoisuuksia.
- Miehillä lääkettä käytetään pitkälle edenneen eturauhassyövän hoitoon.
- Naisilla lääkettä käytetään vaikean endometrioosin ja kohdun myoomien hoidossa.
- Lapsilla (alle 9-vuotiaat tytöt ja alle 10-vuotiaat pojat) lääkettä käytetään ennenaikaisen murrosiän hoidossa laskemaan sukupuolihormonien pitoisuus normaalille tasolle.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Enanton Depot Dual -hoidon alussa sairauden oireet voivat tilapäisesti paheta. Hoidon jatkuessa oireet kuitenkin yleensä helpottuvat.
Älä käytä Enanton Depot Dual -valmistetta, jos:
- olet allerginen leuproreliiniasetaatille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa) tai muille leuproreliinin kaltaisille aineille (synteettiselle GnRH:lle tai GnRH-johdannaisille)
- sinulla on verenvuotoa emättimestä, jonka syytä ei ole selvitetty
- olet tai epäilet olevasi raskaana tai imetät.
Varoitukset ja varotoimet
Keskustele lääkärin kanssa ennen kuin käytät Enanton Depot Dual ‑valmistetta, jos sinulla on:
- virtsatietukos
- selkäydinvaurio
- diabetes
- suurentunut riski saada aineenvaihdunta-, sydän- tai verisuonisairauksia
- jokin sydän- tai verisuonisairaus, kuten sydämen rytmihäiriö (arytmia), tai sinua hoidetaan lääkkeillä sen takia. Sydämen rytmihäiriön riski voi kasvaa kun käytetään Enanton Depot Dual ‑valmistetta.
- osteoporoosi ja suurentunut riski luunmurtumiin
- epilepsia tai sinulla on ollut epileptisiä kohtauksia
- rasvamaksasairaus.
Potilailla, jotka käyttävät Enanton Depot Dual ‑valmistetta on raportoitu masennusta, joka saattaa olla vakavaa. Kerro lääkärille, jos Enanton Depot Dual ‑valmisteen käytön yhteydessä sinulle ilmaantuu masentuneisuutta.
Jos sinulle (tai lapsellesi) ilmaantuu kovaa tai toistuvaa päänsärkyä, näköhäiriöitä ja korvien soimista tai surinaa, ota välittömästi yhteys lääkäriin.
Leuproreliinin yhteydessä on raportoitu vaikeita ihottumia, mukaan lukien Stevens–Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi (SJS/TEN). Lopeta leuproreliinin käyttö ja hakeudu välittömästi lääkärin hoitoon, jos havaitset jotakin näihin vakaviin ihoreaktioihin liittyvistä oireista, jotka on kuvattu kohdassa Mahdolliset haittavaikutukset.
Lapset
Jos hoidettavalla lapsella on aivokasvain, hoidon haittoja ja hyötyjä on harkittava erityisen tarkasti.
Tytön hoitoa ei saa aloittaa ennen kuin on varmistettu ettei hän ole raskaana.
Hoidon ensimmäisen kuukauden aikana saattaa esiintyä verenvuotoa tai tiputteluvuotoa emättimestä, mikä on normaalia. Kerro lääkärille, mikäli vuoto tai tiputtelu jatkuu tämän jälkeen.
Kerro lääkärille, jos havaitset paiseen pistoskohdassa. Ihon alle annettava injektio saattaa aiheuttaa pistoskohdassa ärsytystä, joka ilmenee paiseena.
Tämän lääkkeen käyttö saattaa aiheuttaa luun mineraalitiheyden pienenemistä (luiden haurastumista).
Hoidon lopettaminen saattaa johtaa reisiluun kasvulevyn siirtymään.
Muut lääkevalmisteet ja Enanton Depot Dual
Enanton Depot Dual ‑valmisteella voi olla yhteisvaikutuksia joidenkin sydämen rytmihäiriön hoitoon käytettyjen lääkkeiden kanssa (esim. kinidiini, prokaiiniamidi, amiodaroni ja sotaloli) tai lisätä riskiä sydämen rytmihäiriöön kun sitä käytetään joidenkin muiden lääkkeiden kanssa (esim. metadoni (käytetään kivun lievitykseen ja huumeriippuvuuden katkaisuhoitoon), moksifloksasiini (antibiootti), psyykkisten sairauksien hoitoon käytettävät psykoosilääkkeet).
Kerro lääkärille, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä. Tämä koskee sekä reseptilääkkeitä että ilman reseptiä saatavia lääkkeitä, rohdosvalmisteita ja luontaistuotteita.
Kerro lääkärille myös, jos sinulla on muita sairauksia tai allergioita.
Muista mainita Enanton Depot Dual ‑valmisteen käytöstä seuraavien lääkärissä käyntien yhteydessä.
Raskaus ja imetys
Enanton Depot Dual -hoito on kielletty raskauden aikana. Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana.
Hoidon aikana ei saa imettää.
Ajaminen ja koneiden käyttö
Enanton Depot Dual voi vaikuttaa ajokykyyn ja koneiden käyttökykyyn, koska leuproreliiniasetaatin on raportoitu aiheuttaneen väsymystä, näköhäiriöitä ja huimausta.
Lääkkeet voivat heikentää kykyä kuljettaa moottoriajoneuvoa tai suorittaa erityistä tarkkaavaisuutta vaativia tehtäviä. On omalla vastuullasi arvioida, pystytkö näihin tehtäviin lääkehoidon aikana. Lääkkeen vaikutuksia ja haittavaikutuksia on kuvattu muissa kappaleissa. Lue koko pakkausseloste opastukseksesi. Keskustele lääkärin tai apteekkihenkilökunnan kanssa, jos olet epävarma.
Enanton Depot Dual 3,75 mg -valmiste sisältää liivatetta, joka saattaa joissakin harvinaisissa tapauksissa aiheuttaa voimakkaan allergisen reaktion ja anafylaksian oireita (nokkosrokko, hengenahdistus, huulten ja kurkunpään turpoaminen, jne.).
Enanton Depot Dual sisältää polysorbaattia
Enanton Depot Dual 3,75 mg ja 11,25 mg -valmisteet sisältävät polysorbaattia 1,0 mg/injektioruisku. Polysorbaatit saattavat aiheuttaa allergisia reaktioita. Jos sinulla/lapsellasi on allergioita, kerro asiasta lääkärille.
Muut apuaineet
Enanton Depot Dual 3,75 mg ja 11,25 mg -valmisteet sisältävät alle 1 mmol (23 mg) natriumia per annos eli niiden voidaan sanoa olevan ”natriumittomia”.
Miten valmistetta käytetään
Lääkäri on määrännyt sinulle ja sairauteesi sopivan annostuksen sekä hoidon keston. Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt. Jos valmisteen vaikutus on mielestäsi liian voimakas tai liian heikko, ota yhteys lääkäriin tai apteekkihenkilökuntaan.
Enanton Depot Dual -valmisteen saa antaa vain lääkäri tai hoitohenkilökunta. He myös huolehtivat valmisteen käyttövalmiiksi saattamisesta.
Lääkeinjektio annetaan ihon alle. Laskimoon annettu ruiske saattaa aiheuttaa verisuonitukoksen.
Lääkäri tai sairaanhoitaja antaa sinulle injektion. Katso kohta ”Injektion valmistaminen ja antotapa” pakkausselosteen lopusta.
Annostus
Prostatasyöpä:
Suositeltu annos on 3,75 mg:n kerta-annos joka neljäs viikko tai 11,25 mg kolmen kuukauden välein.
Hoitoa ei tule tilapäisesti keskeyttää tai lopettaa ennenaikaisesti oireiden lieventyessä tai tuumorin koon pienentyessä.
Lääkettä tulee antaa varoen potilaille, joilla on tai joille voi kehittyä virtsatietukos tai selkäydinvaurioita.
Endometrioosi:
Suositeltu annos on 3,75 mg:n kerta-annos joka neljäs viikko korkeintaan kuuden kuukauden ajan. Hoito tulisi aloittaa kuukautiskierron 1.‑5.:n vuorokauden aikana.
Kohdun myoomat:
Suositeltu annos on 3,75 mg:n kerta-annos joka neljäs viikko korkeintaan kolmen kuukauden ajan.
Käyttö lapsille
Hoidon aikana lääkäri seuraa lapsen painoa sekä hoidon tehoamista, tarvittaessa mm. verikokeiden avulla. Annosta muutetaan tarvittaessa. Hoito voi kestää kuukausia, jopa vuosia ja hoidon lopettamisesta päätetään yhdessä lääkärin kanssa.
20 kg tai enemmän painavat lapset
Enanton Depot Dual 3,75 mg: 1 ml (3,75 mg) injektiona ihon alle kerran kuukaudessa.
Enanton Depot Dual 11,25 mg: 1 ml (11,25 mg) injektiona ihon alle joka 3. kuukausi.
Enanton Depot Dual -valmisteiden annostelussa käytettävä esitäytetty injektioruisku ei sovellu alle 1 ml:n annosteluun, joten valmisteita ei tule käyttää alle 20 kg painaville lapsille. Myös hoidon aikaisia annosmuutoksia tehtäessä on huomioitava, että injektioruisku ei sovellu alle 1 ml:n annoksille.
Injektio tulisi antaa mahdollisimman täsmällisesti, kerran kuukaudessa annettaessa 30 päivän välein ja joka 3. kuukausi annettaessa 90 päivän välein. Ajankohtaa ei tulisi aikaistaa tai myöhentää yli 2 vuorokaudella.
Jos otat enemmän Enanton Depot Dual -valmistetta kuin sinun pitäisi
Jos olet ottanut liian suuren lääkeannoksen tai vaikkapa lapsi on ottanut lääkettä vahingossa, ota aina yhteyttä lääkäriin, sairaalaan tai Myrkytystietokeskukseen (puh. 0800 147 111) riskien arvioimiseksi ja lisäohjeiden saamiseksi.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa. Haittavaikutuksia esiintyy erityisesti hoidon alussa, mikä johtuu pääasiassa lääkkeen vaikutuksesta hormonitoimintaan.
Aivolisäkeperäinen halvaus (pituitaarinen apopleksia) on kuvattu erittäin harvinaisena haittavaikutuksena, kun tämän tyyppistä lääkettä on annettu ensimmäistä kertaa potilaille, joilla on aivolisäkkeen kasvain. Apopleksian oireita ovat äkillinen päänsärky, oksentelu, näköhäiriöt ja silmälihashalvaus.
Esiintymistiheys tuntematon (koska saatavissa oleva tieto ei riitä arviointiin):
Hakeudu kiireellisesti hoitoon, jos saat seuraavia oireita:
- punoittavia läiskiä keholla (maalitaulun näköisiä tai rengasmaisia läiskiä, jotka eivät ole koholla ja joiden keskellä saattaa olla rakkuloita), ihon kesimistä, haavaumia suussa, nielussa, nenässä, sukupuolielimissä ja silmissä. Näitä vakavia ihottumia voivat edeltää kuume ja flunssankaltaiset oireet. (Stevens–Johnsonin oireyhtymä/toksinen epidermaalinen nekrolyysi/eksfoliatiivinen dermatiitti).
- ihon punoitus ja kutiseva ihottuma (toksinen ihottuma)
- rakkulaihottuma
- ihoreaktio, joka aiheuttaa iholle punaisia täpliä tai läiskiä, joiden muoto saattaa muistuttaa maalitaulua (tummanpunainen keskiosa, jota ympäröivät vaaleammat punertavat renkaat) (erythema multiforme)
- nopeasti ilmaantuvat punaiset ihoalueet, jotka ovat täynnä pieniä märkärakkuloita (pieniä rakkuloita, joissa on valkoista tai keltaista nestettä; reaktiota kutsutaan akuutiksi yleistyneeksi eksantematoottiseksi pustuloosiksi [AGEP]).
Prostatasyöpä
Hoidon alussa sairauden oireet voivat ohimenevästi paheta, mistä voi seurata luukipua, virtsatiehyiden oireita, alaraajojen heikkoutta ja harhatuntemuksia. Lisäksi Enanton Depot Dual ‑valmisteen käytön yhteydessä voi ilmetä muutoksia aineenvaihdunnassa (esim. glukoosi‑intoleranssia tai diabeteksen pahentumista) tai sydän‑ ja verisuonitapahtumien riskin suurenemista.
Yleiset haittavaikutukset (voi esiintyä enintään 1 käyttäjällä 10:stä):
Mielialan vaihtelu, masennus, unettomuus, kuumat aallot, laktaattidehydrogenaasi-entsyymin pitoisuuden nousu, maksan toiminnan häiriö (keltaisuus), hikoilu, lihasheikkous, vähentynyt seksuaalinen halu ja kyky, kivesten pieneneminen, pistoskohdan reaktio, kuumotus.
Melko harvinaiset haittavaikutukset (voi esiintyä enintään 1 käyttäjällä 100:sta):
Anemia, verihiutaleiden väheneminen, painon muutos, ruokahaluttomuus, triglyseridi‑, kolesteroli‑, sokeri‑, kalium‑ tai virtsahappopitoisuuden nousu veressä, päänsärky, huimaus, tuntoharhat (ihon kihelmöinti), kuurous, korvien soiminen, muutoksia EKG:ssä, sydämen suureneminen, kasvojen kuumotus, pahoinvointi, oksentelu, bilirubiinipitoisuuden ja maksa‑arvojen nousu veressä, ihotulehdus, lisääntynyt hiustenkasvu, ihottuma, kutina, nivel‑, luu‑, hartia‑, alaselkä‑ tai raajakipu, tihentynyt virtsaamistarve, verivirtsaisuus, veren ureapitoisuuden nousu, rintojen kasvu, epämiellyttävä tunne lantionpohjan alueella, kävelemisvaikeudet, turvotus, paineen tunne rinnassa, jäykkyys, huonovointisuus, väsymys, kuume, oireet injektioalueella (kipu, kovettumat, punoitus).
Harvinaiset haittavaikutukset (voi esiintyä enintään 1 käyttäjällä 1 000:sta):
Yliherkkyys, ihottuma, kutina, nokkosihottuma, hengityksen vinkuminen, kuume, vilunväristykset ja anafylaktinen reaktio, veritulppa, keuhkoveritulppa, ripuli, lihaskipu, injektioalueen märkäpesäkkeet.
Hyvin harvinaiset haittavaikutukset (voi esiintyä enintään 1 käyttäjällä 10 000:sta):
Aivolisäkeperäinen halvaus.
Esiintymistiheys tuntematon (koska saatavissa oleva tieto ei riitä arviointiin):
Metabolinen oireyhtymä kuten kohonnut verenpaine, dyslipidemia (aineenvaihduntahäiriöstä johtuva haitallinen tila, jossa veren lipidien suhteelliset osuudet tai pitoisuudet poikkeavat tavoitearvoista), insuliiniresistenssi (ominaisuus jonka takia insuliini pienentää veren glukoosipitoisuutta odotettua vähemmän) tai heikentynyt insuliinitoleranssi, rasvamaksa, epileptinen kohtaus, näköhäiriö, sydämentykytys, muutokset EKG:ssä (QT‑ajan pidentyminen), keuhkotulehdus, keuhkosairaus, luukato (sis. selkärangan murtuma), luun mineraalipitoisuuden lasku, idiopaattinen kallonsisäisen paineen (aivopaineen) kohoaminen (jonka oireita ovat päänsärky, kaksoiskuvat ja muut näköhäiriöt sekä korvan tai korvien soiminen tai surina).
Endometrioosi ja myooma
Yleiset haittavaikutukset (voi esiintyä enintään 1 käyttäjällä 10:stä):
Emättimen kuivuus tai tulehdukset, rintojen arkuus, painon muutokset, tunne‑elämän vaihtelu, unettomuus, päänsärky, huimaus, tuntoharhat, hikoilu, kuumat aallot, kuumotus, nivelsärky, luukipu, lihasheikkous, hartioiden jäykkyys.
Melko harvinaiset haittavaikutukset (voi esiintyä enintään 1 käyttäjällä 100:sta):
Muutokset verenkuvassa (punasolujen määrän lisääntyminen, valkosolujen sekä verihiutaleiden määrän väheneminen, pidentynyt veren hyytymisaika), fosfori‑, kalsium‑ ja kaliumpitoisuuksien nousu veressä, kolesteroli‑ ja triglyseridipitoisuuksien nousu veressä, ruokahaluttomuus, mielialan vaihtelu, masennus, ärtyneisyys, alakuloisuus, raajojen tunnottomuus, karpaalitunnelisyndrooma (rannekanavaoireyhtymä), näköhäiriöt, korvien soiminen, sydämentykytys, kohonnut verenpaine, pahoinvointi, oksentelu, vatsakipu, turvotuksen tunne mahassa, ripuli, ummetus, suutulehdus, huulien tunnottomuus, bilirubiinipitoisuuden ja maksa‑arvojen nousu veressä, maksan toiminnan häiriö (keltaisuus), akne, kuiva iho, hiustenlähtö, runsaskarvaisuus, kynsimuutokset, ihottuma, kutina, nivelten jäykkyys, lannealueen kipu, lihaskipu, jalkakipu, tihentynyt virtsaamistarve, kivulias virtsaaminen, veren ureapitoisuuden nousu, emätinverenvuoto, vähentynyt seksuaalinen halu, yhdyntäkivut, lisääntynyt valkovuoto, munasarjojen hyperstimulaatio ‑oireyhtymä, rintojen turvotus, rintojen pieneneminen, oireet injektioalueella (kipu, kovettumat, punoitus), väsymys, huonovointisuus, epämiellyttävä tunne rinnan alueella, turvotus, jano.
Harvinaiset haittavaikutukset (voi esiintyä enintään 1 käyttäjällä 1 000:sta):
Yliherkkyys, ihottuma, kutina, nokkosihottuma, hengityksen vinkuminen, kuume, vilunväristykset ja anafylaktinen reaktio, veritulppa, keuhkoveritulppa, injektioalueen märkäpesäkkeet.
Hyvin harvinaiset haittavaikutukset (voi esiintyä enintään 1 käyttäjällä 10 000:sta):
Aivolisäkeperäinen halvaus.
Esiintymistiheys tuntematon (koska saatavissa oleva tieto ei riitä arviointiin):
Anemia, metabolinen oireyhtymä kuten kohonnut verenpaine, dyslipidemia (aineenvaihduntahäiriöstä johtuva haitallinen tila, jossa veren lipidien suhteelliset osuudet tai pitoisuudet poikkeavat tavoitearvoista), insuliiniresistenssi (ominaisuus jonka takia insuliini pienentää veren glukoosipitoisuutta odotettua vähemmän) tai heikentynyt insuliinitoleranssi, rasvamaksa, epileptinen kohtaus, muutokset EKG:ssä (QT‑ajan pidentyminen), keuhkotulehdus, keuhkosairaus, luukato (sis. selkärangan murtuma), luun mineraalipitoisuuden lasku, idiopaattinen kallonsisäisen paineen (aivopaineen) kohoaminen (jonka oireita ovat päänsärky, kaksoiskuvat ja muut näköhäiriöt sekä korvan tai korvien soiminen tai surina).
Haittavaikutukset lapsilla
Yleiset haittavaikutukset (voi esiintyä enintään 1 käyttäjällä 10:stä):
Mielialan vaihtelu, masennus, päänsärky, vatsakipu / vatsan kouristelu, pahoinvointi/oksentelu, akne, emätinverenvuoto, tiputteluvuoto, erite, pistoskohdan reaktiot.
Hyvin harvinaiset haittavaikutukset (voi esiintyä enintään 1 käyttäjällä 10 000:sta):
Yliherkkyys, ihottuma, kutina, nokkosihottuma, hengityksen vinkuminen, kuume, vilunväristykset ja anafylaktinen reaktio, aivolisäkeperäinen halvaus.
Esiintymistiheys tuntematon (koska saatavissa oleva tieto ei riitä arviointiin):
Epileptinen kohtaus, keuhkotulehdus, keuhkosairaus, lihaskipu, idiopaattinen kallonsisäisen paineen (aivopaineen) kohoaminen (jonka oireita ovat päänsärky, kaksoiskuvat ja muut näköhäiriöt sekä korvan tai korvien soiminen tai surina), rasvamaksa.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä säilytä kylmässä. Ei saa jäätyä.
Käyttövalmis suspensio on käytettävä välittömästi.
Älä käytä tätä lääkettä pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Enanton Depot Dual sisältää
Enanton Depot Dual 3,75 mg: Valmisteen vaikuttava aine on leuproreliiniasetaatti, jota on 3,75 mg (vastaa 3,57 mg leuproreliiniemästä) esitäytetyssä ruiskussa. Injektiokuiva-aineen apuaineet ovat poly(maitohappo-glykolihappo) sekapolymeeri (75:25 mol%), mannitoli ja liivate.
Esitäytetty kaksikammioruisku sisältää 1 ml liuotinta, jonka koostumus on: mannitoli, karmelloosinatrium, polysorbaatti 80, väkevä etikkahappo (pH:n säätöön) ja injektionesteisiin käytettävä vesi.
Enanton Depot Dual 11,25 mg: Valmisteen vaikuttava aine on leuproreliiniasetaatti, jota on 11,25 mg (vastaa 10,72 mg leuproreliiniemästä) esitäytetyssä ruiskussa. Injektiokuiva-aineen apuaineet ovat: poly(maitohappo) ja mannitoli.
Esitäytetty kaksikammioruisku sisältää 1 ml liuotinta, jonka koostumus on: mannitoli, karmelloosinatrium, polysorbaatti 80, väkevä etikkahappo (pH:n säätöön) ja injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoot
Valkoinen jauhe ja kirkas, väritön liuos.
Enanton Depot Dual 3,75 mg:
1 tai 3 esitäytettyä ruiskua turvasuojuksellisella neulalla, injektiokuiva-aine ja liuotin suspensiota varten
Enanton Depot Dual 11,25 mg:
1 esitäytetty ruisku turvasuojuksellisella neulalla, injektiokuiva-aine ja liuotin suspensiota varten
Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija
Orion Corporation
Orionintie 1
02200 Espoo
Valmistaja
Orion Corporation Orion Pharma
Orionintie 1
02200 Espoo
Orion Corporation Orion Pharma
Joensuunkatu 7
24100 Salo
Tämä pakkausseloste on tarkistettu viimeksi 28.10.2024
Ohjeet terveydenhuollon ammattilaiselle
Injektion valmistaminen ja antotapa
Injektiokuiva-aine ja liuotin sekoitetaan ennen käyttöä. HUOM! Älä vedä mäntää taaksepäin missään vaiheessa, koska tämän seurauksena tulpat erkaantuvat toisistaan, mikä voi johtaa vuotamiseen tulppien väleistä tai ruiskun mäntäpuolelta.
Yleisiä ohjeita
- Varmista, että suspensio on tasa-aineinen ennen annostelua.
- Käytä valmis suspensio välittömästi.
- Lääkettä ei saa pistää samaan paikkaan kahta kertaa peräkkäin, vaan pistoskohtaa tulee vaihdella.
- Käyttövalmista suspensiota ei saa säilyttää, koska valmiste ei sisällä säilöntäainetta.
- Pistoskohtaa ei saa hieroa.
- Peitä injektiokohta tarvittaessa laastarilla.
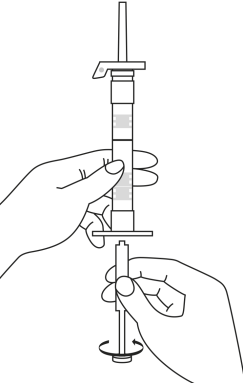 | 1. Pidä ruisku pystyasennossa (neula ylöspäin). Männän varsi kierretään kiinni ruiskun päähän kunnes taaempi kumitulppa alkaa liikkua. | 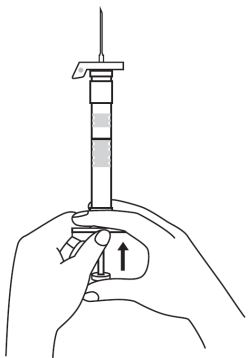 | 5. Pidä ruiskua siten, että neula osoittaa ylöspäin, jotta näet, onko ruiskun sisällä ilmakuplia. Jos ilmakuplia näkyy, paina mäntää varovasti, kunnes kaikki ilma (mutta ei yhtään nestettä) poistuu ruiskusta. |
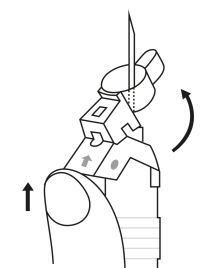
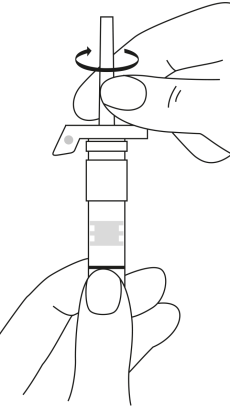 | 2. Pidä ruisku pystyasennossa (neula ylöspäin). Tarkista, että neula on kunnolla kiinnitetty ruiskuun kiertämällä neulansuojuksesta myötäpäivään. Varo kiertämästä liian tiukkaan. Naputa ruiskua varovasti sormella, jotta jauhe irtoaa kammion seinästä. |
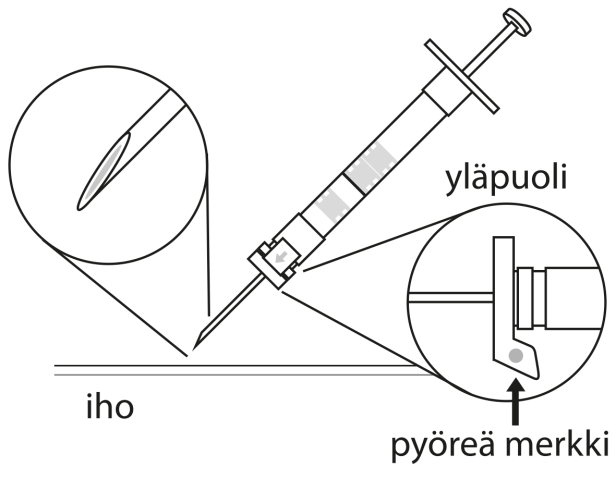
6. Puhdista ihoalue ennen pistosta antiseptisella aineella. Injektiota annettaessa turvasuojuksen pyöreän merkin tulee osoittaa ylöspäin. Varmista, että neula ei lävistä verisuonta ja injisoi ruiskun koko sisältö kerralla ihonalaisesti, kuten normaalia injektiota annettaessa. | |
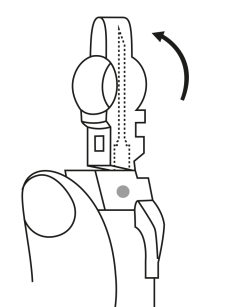
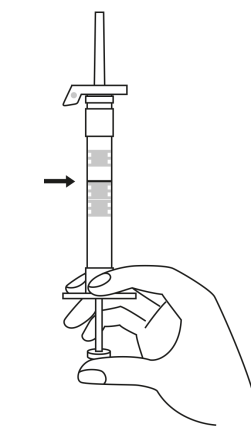 | 3. Pidä ruisku pystyasennossa (neula ylöspäin). Työnnä mäntää hitaasti (6‑8 sekuntia) kunnes keskimmäisen kumitulpan yläosa on sinisen viivan kohdalla. | ||
INJEKTION JÄLKEEN 7. Turvasuojuksen vipuun on painettuna nuoli. Heti injektion jälkeen työnnä sormella turvalaitteen vipua nuolen osoittamaan suuntaan. Tällöin suojus liukuu kohti neulan kärkeä ja lukittuu sen suojaksi. Varmista lukitus kuuntelemalla tai tunnustelemalla (lukituksesta kuuluu “klik” tai tuntuu napsahdus). | |||
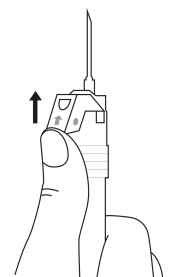
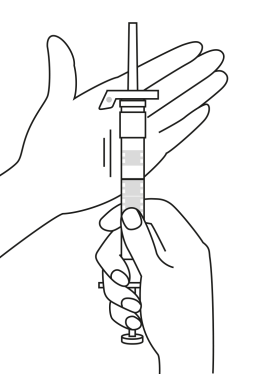 | 4. Pidä ruisku pystyasennossa (neula ylöspäin). Ravistele varovasti ruiskua, kunnes suspensio on tasa-aineinen. Valmis injektio on valkoinen maitomainen suspensio. Vedä varovasti neulan suojus irti. | ||