Pakkausseloste
PREVICOX tuggtablett 57 mg, 227 mg
DET VETERINÄRMEDICINSKA LÄKEMEDLETS NAMN
Previcox 57 mg tuggtabletter för hund
Previcox 227 mg tuggtabletter för hund
DEKLARATION AV AKTIVA SUBSTANSER OCH ÖVRIGA SUBSTANSER
Varje tuggtablett innehåller:
Aktiv substans:
Firocoxib……………………………………………………………………………………….. 57 mg
eller
Firocoxib……………………………………………………………………………………… 227 mg
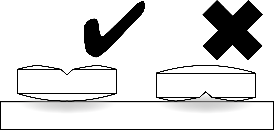
Brun, rund, konvex tuggtablett med en korsformad brytskåra på ena sidan. Tuggabletten kan delas i två eller fyra lika stora delar.
ANVÄNDNINGSOMRÅDEN
Smärtlindring och inflammationshämning i samband med osteoartrit (artros) hos hund.
Smärtlindring och inflammationshämning efter operation i samband med mjukdels-, ortopedisk- och tandkirurgi hos hund.
KONTRAINDIKATIONER
Använd inte till dräktiga eller digivande tikar.
Använd inte till djur yngre än 10 veckor eller som väger mindre än 3 kg.
Använd inte till djur med blödningar i magtarmkanalen, sjukliga blodbildsförändringar eller blödningsrubbningar.
Använd inte samtidigt med andra antiinflammatoriska icke-steroida läkemedel (NSAID) eller kortikosteroider.
BIVERKNINGAR
Mindre vanliga (1 till 10 av 1 000 behandlade djur):
Kräkning och diarré1.
Sällsynta (1 till 10 av 10 000 behandlade djur):
Störningar i centrala och perifera nervsystemet.
Mycket sällsynta (färre än 1 av 10 000 behandlade djur, enstaka rapporterade händelser inkluderade):
Leverrubbningar och njurrubbningar.
1 Vanligtvis av övergående natur och försvinner då behandlingen avbryts.
Avbryt behandlingen och kontakta din veterinär om följande symptom inträffar: kräkning, upprepade diarréer, blod i avföringen, plötslig viktminskning, aptitlöshet, slöhet eller förändringar av biokemiska parametrar (provsvar) för njur- eller leverfunktion. Som med andra NSAID kan allvarliga biverkningar inträffa, som i mycket sällsynta fall kan vara dödliga.
Det är viktigt att rapportera biverkningar. Det möjliggör fortlöpande säkerhetsövervakning av ett läkemedel. Om du observerar biverkningar, även sådana som inte nämns i denna bipacksedel, eller om du tror att läkemedlet inte har fungerat, meddela i första hand din veterinär. Du kan också rapportera eventuella biverkningar till innehavaren av godkännande för försäljning eller den lokala företrädaren för innehavaren av godkännandet för försäljning genom att använda kontaktuppgifterna i slutet av denna bipacksedel, eller via ditt nationella rapporteringssystem.
DJURSLAG
Hund.
DOSERING FÖR VARJE DJURSLAG, ADMINISTRERINGSSÄTT OCH ADMINISTRERINGSVÄGAR
5 mg per kg en gång om dagen.
Vid smärtlindring och inflammationshämning efter operation kan djuren doseras med start cirka 2 timmar före operationen och därefter i upp till 3 dagar. Efter ortopedisk operation kan behandling med samma dagliga dos fortsätta längre än 3 dagar beroende på behandlingssvaret och efter bedömning av behandlande veterinär.
Ges via munnen enligt tabell nedan.
| Kroppsvikt (kg) |
Antal tuggtabletter per styrka |
mg/kg |
|
| 57 mg |
227 mg |
||
| 3,0 – 5,5 |
0,5 |
5,2 – 9,5 |
|
| 5,6 – 7,5 |
0,75 |
5,7 – 7,6 |
|
| 7,6 – 10 |
1 |
0,25 |
5,7 – 7,5 |
| 10,1 – 13 |
1,25 |
5,5 – 7,1 |
|
| 13,1 – 16 |
1,5 |
5,3 – 6,5 |
|
| 16,1 – 18,5 |
1,75 |
5,4 – 6,2 |
|
| 18,6 – 22,5 |
0,5 |
5,0 – 6,1 |
|
| 22,6 – 34 |
0,75 |
5,0 – 7,5 |
|
| 34,1 – 45 |
1 |
5,0 – 6,7 |
|
| 45,1 – 56 |
1,25 |
5,1 – 6,3 |
|
| 56,1 – 68 |
1,5 |
5,0 – 6,1 |
|
| 68,1 – 79 |
1,75 |
5,0 – 5,8 |
|
| 79,1 – 90 |
2 |
5,0 – 5,7 |
|
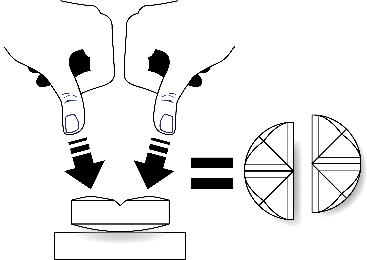
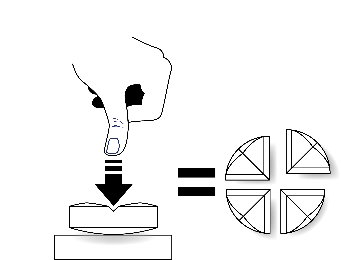
Tabletten kan delas i två eller fyra lika stora delar för att möjliggöra korrekt dosering.
| |
|
|
| Placera tabletten på en plan yta med den skårade sidan uppåt och den konvexa (rundade) sidan mot ytan. |
Två lika stora delar: Tryck ned med tummarna på tablettens båda sidor. |
Fyra lika stora delar: Tryck ned med tummen mitt på tabletten. |
ANVISNING FÖR KORREKT ADMINISTRERING
Tabletter kan ges med eller utan foder. Överskrid inte rekommenderad dos. Behandlingstidens längd avgörs av behandlingssvaret. Data från fältstudier om behandling längre än 90 dagar i föreligger inte. Behandling i mer än 90 dagar skall därför noga övervägas och regelbundet övervakas av veterinär.
KARENSTIDER
Ej relevant.
SÄRSKILDA FÖRVARINGSANVISNINGAR
Förvaras utom syn- och räckhåll för barn.
Förvaras vid högst 30 °C.
Förvaras i originalförpackningen.
Använd inte detta läkemedel efter utgångsdatumet på kartongen efter Exp. Utgångsdatumet är den sista dagen i angiven månad.
Delade tabletter kan förvaras i originalförpackningen i upp till 1 månad.
SÄRSKILDA VARNINGAR
Särskilda försiktighetsåtgärder för säker användning hos det avsedda djurslaget:
Behandling av mycket unga djur, eller djur med misstänkt eller konstaterad nedsatt njur-, hjärt- eller leverfunktion kan innebära en ökad risk. Om behandling inte kan undvikas kräver dessa djur noggrann veterinärövervakning. Lämpliga laboratorietester rekommenderas innan behandling för att upptäcka subklinsk (asymptomatisk) njur- eller leversjukdom som kan öka risken för biverkningar.
Undvik behandling av uttorkade djur eller djur med lågt blodtryck då det kan leda till en ökad risk för njurskador. Samtidig behandling med läkemedel som kan skada njurarna bör undvikas.
När det finns risk för blödning i magtarmkanalen, eller om djuret tidigare uppvisat intolerans mot NSAID, skall behandling med detta läkemedel noggrant övervakas av veterinär. Avbryt behandlingen om följande symptom observeras: upprepade diarréer, kräkning, blod i avföringen, plötslig viktminskning, aptitlöshet, slöhet eller förändringar av biokemiska parametrar (provresultat) för njur- eller leverfunktion.
Särskilda försiktighetsåtgärder för personer som ger läkemedlet till djur:
Tvätta händerna efter hantering av läkemedlet.
Vid oavsiktligt intag, uppsök genast läkare och visa denna information eller etiketten.
Delade tabletter ska förvaras i originalförpackningen.
Dräktighet och digivning:
Använd inte under dräktighet och digivning.
Laboratoriestudier på kanin har visat skadliga effekter på foster och moderdjur vid doser motsvarande rekommenderad dos för hund.
Interaktioner med andra läkemedel och övriga interaktioner:
Förbehandling med andra antiinflammatoriska läkemedel kan resultera i ytterligare eller ökad frekvens av biverkningar. Om andra antiinflammatoriska läkemedel använts skall därför en behandlingsfri period på minst 24 timmar iakttas innan behandling med läkemedlet påbörjas. Vid bestämning av den behandlingsfria perioden skall också det första läkemedlets farmakokinetiska egenskaper beaktas.
Använd inte läkemedlet samtidigt med andra NSAID eller kortikosteroider. Sår i magtarmkanalen hos djur behandlade med NSAID kan förvärras av kortikosteoider.
Samtidig behandling med läkemedel som påverkar njurflödet, t.ex. vätskedrivande eller så kallade angiotensinkonvertashämmare (ACE-hämmare), ska övervakas av veterinär. Samtidig behandling med läkemedel som kan skada njurarna bör undvikas då det kan leda till en ökad risk för njurskador. Då anestesimedel kan påverka njurflödet ska parenteral vätsketerapi (dropp) övervägas vid operation för att minska risken för njurpåverkan vid NSAID-behandling i samband med operation.
Samtidig behandling med andra aktiva substanser som har hög proteinbindningsgrad kan konkurrera med firocoxibs proteinbindning och därmed orsaka biverkningar.
Överdosering:
Hos hundar som var 10 veckor vid studiestart och behandlade med minst 25 mg/kg/dag (5 gånger rekommenderad dos) under 3 månader observerades följande biverkningar: viktminskning, aptitlöshet, leverförändringar (fettackumulering), hjärnförändringar (vakuolisering), förändringar i tolvfingertarmen (sår) och även dödsfall. Liknande biverkningar observerades vid doser om minst 15 mg/kg/dag (3 gånger rekommenderad dos) under 6 månader, dock med lägre frekvens och allvarlighetsgrad samt avsaknad av sår i tolvfingertarmen.
De observerade biverkningarna i dessa säkerhetsstudier på hundar var övergående hos en del hundar när behandlingen avbröts.
Hos hundar som var 7 månader vid studiestart och behandlade med minst 25 mg/kg/dag (5 gånger rekommenderad dos) under 6 månader observerades biverkningar i magtarmkanalen, dvs. kräkning.
Överdosstudier har inte genomförts på djur äldre än 14 månader.
Om symptom på överdosering observeras skall behandlingen avbrytas.
SÄRSKILDA FÖRSIKTIGHETSÅTGÄRDER FÖR DESTRUKTION AV EJ ANVÄNT LÄKEMEDEL ELLER AVFALL, I FÖREKOMMANDE FALL
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall.
Använd retursystem för kassering av ej använt läkemedel eller avfall från läkemedelsanvändningen i enlighet med lokala bestämmelser. Dessa åtgärder är till för att skydda miljön.
Fråga veterinären eller apotekspersonal hur man gör med läkemedel som inte längre används.
DATUM DÅ BIPACKSEDELN SENAST GODKÄNDES
20.10.2023
Verkningssätt:
Firocoxib är ett antiinflammatoriskt icke-steroid läkemedel (NSAID) som verkar genom selektiv hämning av cyklooxygenas-2 (COX-2) -medierad prostaglandinsyntes. COX-2 är den isoform av enzymet som antas vara primärt ansvarig för syntesen av prostanoida förmedlare av smärta, inflammation och feber. I in vitro tester (hund helblodstest) har firocoxib visat sig vara c:a 380 gånger mer selektivt för COX-2 än för COX-1.
Tuggtabletten är delbar för att underlätta korrekt dosering. Previcox innehåller smakämnen (sockerkulör och röksmak) för att underlätta administrering till hundar.
NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV GODKÄNNANDE FÖR FÖRSÄLJNING OCH NAMN PÅ OCH ADRESS TILL INNEHAVAREN AV TILLVERKNINGSTILLSTÅND SOM ANSVARAR FÖR FRISLÄPPANDE AV TILLVERKNINGSSATS, OM OLIKA
Innehavare av godkännande för försäljning:
Boehringer Ingelheim Vetmedica GmbH
55216 Ingelheim/Rhein
Tyskland
Tillverkare ansvarig för frisläppande av tillverkningssats:
Boehringer Ingelheim Animal Health France SCS,
4 Chemin du Calquet, 31000 Toulouse
Frankrike
Lokal företrädare och kontaktuppgifter för att rapportera misstänkta biverkningar:
Suomi/Finland Vetcare Oy PL/PB 99 24101 Salo
Puh/Tel: + 358 201443360