Pakkausseloste
YONDELIS pulver till koncentrat till infusionsvätska, lösning 0,25 mg, 1 mg
Tilläggsinformation
Yondelis 0,25 mg pulver till koncentrat till infusionsvätska, lösning
Yondelis 1 mg pulver till koncentrat till infusionsvätska, lösning
trabektedin
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor, vänd dig till läkare.
- Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Yondelis är och vad det används för
2. Vad du behöver veta innan du använder Yondelis
3. Hur du använder Yondelis
4. Eventuella biverkningar
5. Hur Yondelis ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Yondelis innehåller den aktiva substansen trabektedin. Yondelis är ett cancerläkemedel som verkar genom att hindra tumörcellerna från att föröka sig.
Yondelis används för att behandla patienter med framskridet mjukdelssarkom, när tidigare läkemedelsbehandling inte har varit framgångsrik eller inte har varit lämplig för patienten. Mjukdelssarkom är en malign (elakartad) sjukdom som börjar någonstans i kroppens mjukdelar, såsom muskler, fett eller andra vävnader (exempelvis brosk eller kärl).
Yondelis i kombination med pegylerat liposomalt doxorubicin (PLD: ett annat cancerläkemedel) används för behandling av patienter med äggstockscancer, som återkommit efter minst 1 tidigare behandling och inte är resistent mot cancerläkemedel som innehåller platinumföreningar.
Vad du behöver veta innan produkten används
Använd inte Yondelis
- om du är allergisk mot trabektedin eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar)
- om du har någon allvarlig infektion
- om du ammar
- om du kommer att få vaccin mot gula febern.
Varningar och försiktighet
Tala med läkare innan du använder Yondelis.
Yondelis eller dess kombination med PLD ska inte användas om du har en allvarlig lever-, njur- eller hjärtskada.
Tala om för din läkare om du vet eller misstänker att du har något av följande innan du påbörjar behandling med Yondelis:
- lever-eller njurbesvär
- hjärtbesvär eller tidigare haft hjärtbesvär
- vänsterkammarejektionsfraktion (LVEF) under nedre normalgränsen
- tidigare har fått behandling med trabektedin i höga doser.
Sök omedelbart medicinsk vård om något av följande inträffar:
- Du får feber, eftersom Yondelis kan ge biverkningar som påverkar blod och lever.
- Om du mår illa, kräks eller inte kan dricka något och därför inte kissar så ofta, trots att du fått medel mot illamående.
- Om du får svår muskelvärk eller -svaghet, eftersom det kan vara ett tecken på skada på musklerna (rabdomyolys); se avsnitt Eventuella biverkningar).
- Om du märker att Yondelis infusion läcker ut från venen under tiden du får den. Det kan medföra att vävnadscellerna runt injektionsstället skadas och dör (vävnadsnekros, se även avsnitt Eventuella biverkningar), vilket kan kräva kirurgi.
- Om du får en allergisk reaktion (överkänslighet). I detta fall kan du få ett eller fler av följande sjukdomstecken: feber, svårighet att andas, hudrodnad eller utslag, känsla av illamående (kväljningar) eller illamående (kräkningar; se avsnitt Eventuella biverkningar).
- Om du upptäcker oförklarlig delvis eller allmän svullnad (ödem), med eventuell omtöcknadskänsla, yrsel eller törst (lågt blodtryck). Det kan vara tecken på ett tillstånd (kapillärläckagesyndrom) som kan leda till överdriven ansamling av vätska i vävnaden, och behöver snabb läkarbedömning.
Barn och ungdomar
Yondelis bör inte ges till barn under 18 års ålder med pediatriska sarkom.
Andra läkemedel och Yondelis
Tala om för läkare eller apotekspersonal om du använder, nyligen har använt eller kan tänkas använda andra läkemedel.
Du får inte använda Yondelis om du ska få gula febern-vaccin och det är inte lämpligt att ta Yondelis om du får ett vaccin som innehåller levande viruspartiklar. Effekten hos läkemedel som innehåller fenytoin (mot epilepsi) kan minskas om den ges tillsammans med Yondelis och samtidig behandling är därför inte lämplig.
Om du tar något av följande läkemedel under din behandling med Yondelis behöver du kontrolleras noga eftersom det kan medföra att effekterna av Yondelis:
- minskar (exempelvis om du tar läkemedel som innehåller rifampicin (för bakterieinfektioner), fenobarbital (mot epilepsi) eller johannesört (Hypericum perforatum, en örtmedicin mot nedstämdhet)), eller
- ökar (exempelvis om du tar läkemedel som innehåller ketoconazol eller fluconazol (för svampinfektioner), ritonavir (mot infektion med humant immunbristvirus (HIV)), klaritromycin (för bakterieinfektioner), aprepitant (för att förhindra illamående och kräkningar), ciklosporin (hämmar kroppens immunsystem) eller verapamil (mot högt blodtryck och hjärtbesvär)).
Användning av dessa läkemedel tillsammans med Yondelis ska därför om möjligt undvikas.
Om du får Yondelis eller kombinationen Yondelis+PLD tillsammans med ett läkemedel som kan orsaka skada på levern eller musklerna (rabdomyolys), kan du behöva kontrolleras noga, eftersom det kan finns en ökad risk för lever- eller muskelskada. Läkemedel som innehåller statiner (för att sänka kolesterolnivåerna och förhindra hjärtkärlsjukdom) är exempel på läkemedel som kan orsaka muskelskada.
Yondelis med alkohol
Alkoholkonsumtion ska undvikas under behandling med Yondelis eftersom detta kan skada levern.
Graviditet, amning och fertilitet
Graviditet
Yondelis ska inte användas under graviditet. Om du är gravid, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du använder detta läkemedel.
Fertila kvinnor måste använda effektiva preventivåtgärder under behandlingen och under 8 månader därefter.
I händelse av graviditet måste du tala om det för din läkare omedelbart och genetisk rådgivning rekommenderas eftersom Yondelis kan orsaka genetisk skada.
Amning
Yondelis får inte ges till patienter som ammar. Därför måste du sluta amma innan du påbörjar behandlingen och du får inte börja amma igen förrän din läkare har bekräftat att du utan risk kan göra det.
Fertilitet
Fullgod preventivmetod måste användas av fertila män under 5 månader efter avslutad behandling.
Patienter bör få råd om konservering av ägg eller sperma före behandling eftersom det finns risk för permanent infertilitet p.g.a. behandlingen med Yondelis.
Genetisk rådgivning rekommenderas också för patienter som vill få barn efter avslutad behandling.
Körförmåga och användning av maskiner
Under behandling med Yondelis kan du känna dig trött och drabbas av kraftlöshet. Du ska inte köra bil eller använda maskiner om du drabbas av någon av dessa biverkningar.
Yondelis innehåller kalium
Detta läkemedel innehåller mindre än 1 mmol (39 mg) kalium per injektionsflaska, d.v.s. är näst intill ”kaliumfritt”.
Hur produkten används
Yondelis ges under övervakning från en läkare med erfarenhet av kemoterapi. Administreringen får endast utföras av utbildade onkologer eller annan vårdpersonal, som är specialutbildad på administrering av cellgifter.
För behandling av mjukdelssarkom är dosen vanligtvis 1,5 mg/m2 kroppsyta. Under hela behandlingsperioden kommer din läkare att noga följa dig med kontroller och bestämma den dosering av Yondelis som är lämpligast för dig. Den rekommenderade dosen till japanska patienter är lägre än den vanliga dosen för alla andra etniciteter och är 1,2 mg/m2 kroppsyta.
För behandling av äggstockscancer är normaldosen 1,1 mg/m2 kroppsyta efter administrering av 30 mg/m2 kroppsyta av PLD.
Innan du får Yondelis bereds och späds medicinen för intravenös användning. Varje gång du får Yondelis för mjukdelssarkom tar det omkring 24 timmar för all lösningen att gå ut i blodet. Behandlingen av äggstockscancer tar tre timmar.
För att undvika irritation på injektionsstället rekommenderas att Yondelis ges till dig via en central venös infart.
Du kommer att få en annan medicin före behandlingen och vid behov även under behandlingen med Yondelis för att skydda levern och minska risken för illamående och kräkningar.
Du får infusionen var tredje vecka även om läkaren ibland rekommenderar dosfördröjning för att säkerställa att du får den Yondelisdos som är bäst för dig.
Behandlingsperiodens totala längd beror på hur ditt tillstånd utvecklas och hur du mår. Din läkare kommer att tala om för dig hur lång behandlingen blir. Om du har ytterligare frågor om detta läkemedel kontakta din läkare.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel eller dess kombination med PLD orsaka biverkningar, men alla användare behöver inte få dem.
Om du är osäker på vad biverkningarna nedan innebär, bör du be din läkare förklara dem för dig mera ingående.
Allvarliga biverkningar orsakade av behandling med Yondelis:
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare)
- Du kan få förhöjda nivåer av det gula färgämnet bilirubin i blodet, vilket kan ge upphov till gulsot (gulfärgning av hud, slemhinnor och ögon).
- Din läkare kommer att ordinera regelbunden blodprovstagning för att upptäcka eventuella avvikande blodvärden.
Vanliga (kan förekomma hos upp till 1 av 10 användare)
- Du kan också få blodinfektioner (sepsis) om du har allvarligt nedsatt immunsystem. Om du får feber måste du omedelbart söka medicinsk vård.
- Du kan också få värk i musklerna (myalgi). Du kan också få nervskador som kan resultera i muskelvärk, svaghet och domningar. Du kan bli svullen i kroppen eller få svullna ben och en krypande känsla i huden.
- Du kan få en reaktion vid injiceringsstället. Yondelis infusion kan läcka ut från venen när du får den, vilket medför att vävnadscellerna runt injektionsstället skadas och dör (vävnadsnekros, se även avsnitt Vad du behöver veta innan produkten används ”Varningar och försiktighet”), vilket kan kräva kirurgi.
- Du kan få en allergisk reaktion. Du kan få feber, svårighet att andas, hudrodnad eller utslag, känsla av illamående (kväljningar) eller illamående (kräkningar).
- När Yondelis används i kombination med PLD kan du drabbas av synkope, även kallat svimningsanfall. Du kan också uppleva att hjärtat slår för hårt eller för snabbt (hjärtklappning), hjärtkamrarna kan bli svagare (vänsterkammardysfunktion) eller en lungartär kan bli blockerad (lungemboli).
Mindre vanliga (kan förekomma hos upp till 1 av 100 användare)
- Du kan få svår muskelvärk och -smärta, stelhet och muskelsvaghet. Din urin kan också få en mörkare färg. Allt som beskrivs ovan kan vara ett tecken på skada på dina muskler (rabdomyolys).
- Läkaren kan vilja ta blodprov i vissa situationer för att undvika att du utvecklar muskelskada (rabdomyolys). I mycket svåra fall kan detta leda till njursvikt. Om du får svår muskelvärk eller -svaghet måste du omedelbart söka medicinsk vård.
- Du kan få svårighet att andas, oregelbunden hjärtrytm, minskad urinmängd, tvära förändringar i ditt psykiska tillstånd, områden med fläckig hud, extremt lågt blodtryck i samband med onormala laboratorievärden (minskat antal blodplättar). Om du får något av ovan nämnda symtom eller sjukdomstecken, sök vård omedelbart.
- Du kan drabbas av en onormal vätskebildning i lungorna som leder till svullnader (lungödem).
- Om du upptäcker oförklarlig delvis eller allmän svullnad (ödem), med eventuell omtöcknadskänsla, yrsel eller törst (lågt blodtryck). Det kan vara tecken på ett tillstånd (kapillärläckagesyndrom) som kan leda till överdriven ansamling av vätska i vävnaden. Om du får något av ovannämnda symtom eller tecken, uppsök omedelbart sjukvården.
- Du kan märka att Yondelis infusionslösning läcker ut från venen (extravasering) när den ges till dig. Du kommer då att märka av en del rodnad, svullnad, klåda och obehag vid injektionsstället. Om du får något av dessa symtom eller tecken, tala med sjuksköterska eller läkare omedelbart.
Det kan medföra att cellerna i vävnaden kring injektionsstället skadas eller dör (vävnadsnekros), något som kan kräva operation.
En del av symtomen eller tecknen på extravasering kanske inte syns förrän flera timmar efter att extravaseringen har inträffat. Det kan förekomma blåsbildning, hudavflagning och mörkfärgning av huden över stället. De är möjligt att det tar några dagar innan vävnadsskadans hela omfattning syns. Om du får något av ovan beskrivna symtom eller tecken, sök vård omedelbart.
Sällsynta (kan förekomma hos upp till 1 av 1 000 användare)
- Hud och ögonvitor kan bli gulaktiga (gulsot), du kan få smärta i bukens övre högra del, illamående, kräkningar, allmän sjukdomskänsla, koncentrationssvårigheter, känsla av desorientering eller förvirring, sömnighet. Dessa sjukdomstecken kan vara en indikation på leverns oförmåga att fungera normalt. Om du får något av de ovan beskrivna symtomen eller sjukdomstecknen, sök vård omedelbart.
Andra mindre allvarliga biverkningar:
Mycket vanliga (kan förekomma hos fler än 1 av 10 användare)
- Du kan:
- känna dig trött
- få andningssvårighet och hosta
- få ont i ryggen
- få vätskeansamling i kroppen (ödem)
- få fler blåmärken än normalt
- blöda näsblod
- lättare få infektioner. En infektion kan också ge dig förhöjd kroppstemperatur (feber).
Om du får något av dessa symtom måste du söka vård omedelbart.
- Du kan få matsmältningssymtom såsom aptitlöshet, illamående eller kräkningar, smärta i buken, diarré eller förstoppning. Om du blir illamående, kräks eller inte kan dricka någonting och därför inte kissar så ofta, trots att du tar medel mot illamående, måste du söka vård omedelbart.
- Du kan få huvudvärk.
- Du kan få slemhinneinflammation som röda svullnader inuti munhålan som leder till smärtsamma sår och munsår, inflammation i munnen (stomatit) eller inflammation i magtarmkanalen när Yondelis används samtidigt med PLD.
- Patienter som får Yondelis plus PLD för äggstockscancer kan få hand- eller fotproblem. Det kan framträda som röd hud på handflator, fingrar och fotsulor som senare svullnar och blir blålila. Förändringarna kan antingen torka ut och fjälla eller bilda blåsor med sår.
Vanliga (kan förekomma hos upp till 1 av 10 användare)
- Du kan få förlust av vätska från kroppen, viktnedgång, matsmältningsbesvär och förändrat smaksinne.
- Du kan tappa hår.
- Du kan också drabbas av yrsel, lågt blodtryck och blodvallningar eller hudutslag.
- Kraftigare hudpigmentering kan uppträda hos patienter som får Yondelis samtidigt som PLD för äggstockscancer.
- Du kan få ont i leder.
- Du kan få sömnproblem.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare. Detta gäller även eventuella biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt via
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och injektionsflaskans etikett efter EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2 ºC–8 ºC).
Information om stabilitet vid användning av rekonstituerade och utspädda lösningar finns i avsnittet för sjukvårdspersonalen.
Använd inte detta läkemedel om du observerar synliga partiklar efter rekonstituering eller spädning av läkemedlet.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar för cytotoxiska läkemedel.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Den aktiva substansen är trabektedin. Yondelis 0,25 mg: Varje injektionsflaska med pulver innehåller 0,25 mg trabektedin. Yondelis 1 mg: Varje injektionsflaska med pulver innehåller 1 mg trabektedin.
- Övriga innehållsämnen är sackaros, kaliumdivätefosfat, fosforsyra (för pH‑justering) och kaliumhydroxid (för pH‑justering).
Läkemedlets utseende och förpackningsstorlekar
Yondelis är ett pulver till koncentrat till infusionsvätska, lösning. Pulvret har vit till benvit färg och tillhandahålls i en injektionsflaska av glas.
Varje ytterkartong innehåller 1 injektionsflaska med antingen 1 mg eller 0,25 mg trabektedin.
Innehavare av godkännande för försäljning och tillverkare
Pharma Mar, S.A.
Avda. de los Reyes 1
Polígono Industrial La Mina
28770 Colmenar Viejo (Madrid)
SPANIEN
Tel: +34 91 846 60 00
Fax: +34 91 846 60 01
Kontakta innehavaren av godkännandet för försäljning om du vill veta mer om detta läkemedel.
Denna bipacksedel ändrades senast 02/2025
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats https://www.ema.europa.eu .
Direktiv för experterna inom hälsovården
Instruktioner för beredning, hantering och kassering
Tillämpliga rutiner för korrekt hantering och kassering av cytotoxiska läkemedel måste följas. Ej använt läkemedel och avfall ska kasseras enligt gällande lokala riktlinjer för cytotoxiska läkemedel.
Du ska ha fått utbildning i korrekt teknik för att bereda och späda Yondelis eller dess kombination med PLD och du ska bära skyddskläder, inklusive mask, skyddsglasögon och handskar, under beredning och spädning. Oavsiktlig kontakt med hud, ögon eller slemhinnor måste behandlas omedelbart med rikliga mängder vatten. Du ska inte hantera detta läkemedel om du är gravid.
Beredning för intravenös infusion
Yondelis måste beredas och spädas ytterligare före infusion. Se också avsnitt Hur produkten används. Lämpliga aseptiska tekniker måste användas.
Yondelis får inte administreras i form av en blandning med andra läkemedel i samma infusion, med undantag för spädningsvätskan. Inga inkompatibiliteter har observerats mellan Yondelis och flaskor av typ I-glas, påsar/slangar av polyvinylklorid (PVC) och polyeten (PE), behållare av polyisopren eller implanterbara system av titan för tillgång till blodbanan.
Vid användning av Yondelis i kombination med PLD måste man spola den intravenösa kanalen noga med 50 mg/ml (5 %) glukoslösning för infusion efter administrering av PLD och före administrering av Yondelis. Användning av annat spädningsmedel än 50 mg/ml (5 %) glukoslösning för infusion kan orsaka utfällning av PLD. (Se även produktresumén för PLD för specifika hanteringsråd).
Anvisningar för rekonstituering
Yondelis 0,25 mg/injektionsflaska: Injicera 5 ml sterilt vatten för injektionsvätskor i injektionsflaskan
Yondelis 1 mg/injektionsflaska: Injicera 20 ml sterilt vatten för injektionsvätskor i injektionsflaskan.
En spruta används för att injicera korrekt mängd sterilt vatten för injektioner i injektionsflaskan. Skaka injektionsflaskan tills innehållet har löst sig helt. Den färdigberedda lösningen är klar, färglös eller något gulaktig och väsentligen fri från synliga partiklar.
Denna rekonstituerade lösning innehåller 0,05 mg/ml trabektedin. Den kräver ytterligare utspädning och är endast avsedd för engångsbruk.
Anvisningar för spädning
Späd den rekonstituerade lösningen med natriumklorid 9 mg/ml (0,9 %) infusionsvätska, lösning eller glukos 50 mg/ml (5 %) infusionsvätska, lösning. Beräkna volymen som behövs enligt följande:
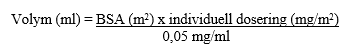
BSA = Body Surface Area (kroppsyta)
Dra upp lämplig mängd rekonstituerad lösning från injektionsflaskan. Om intravenös administrering ska ske via en central venkateter tillsätts den rekonstituerade lösningen till en infusionspåse innehållande ≥ 50 ml spädningsvätska (natriumklorid 9 mg/ml (0,9 %) infusionsvätska, lösning eller glukos 50 mg/ml (5 %) infusionsvätska, lösning), så att koncentrationen av trabektedin i infusionslösningen blir ≤ 0,030 mg/ml.
Om det inte är möjligt att anlägga någon central venös infart och en perifer venös infart måste användas, ska den rekonstituerade lösningen tillsättas en infusionspåse innehållande ≥ 1 000 ml spädningsvätska (natriumklorid 9 mg/ml (0,9 %) infusionsvätska, lösning eller glukos 50 mg/ml (5 %) infusionsvätska, lösning).
Parenterala lösningar ska besiktigas visuellt med avseende på partiklar före intravenös administrering. När infusionslösningen är färdigberedd ska den administreras omedelbart.
Lösningarnas stabilitet under användning
Rekonstituerad lösning
Efter rekonstituering har kemisk och fysikalisk stabilitet visats under 30 timmar upp till 25 ºC.
Från mikrobiologisk synpunkt ska den beredda lösningen spädas och användas omedelbart. Om den beredda lösningen inte späds och används omedelbart, är förvaringstiden för lösningen, liksom förhållandena före användning, användarens ansvar och bör normalt sett inte överskrida 24 timmar vid 2 ºC–8 ºC, såvida inte beredningen har ägt rum under kontrollerade och validerade aseptiska förhållanden.
Utspädd lösning
Efter spädning har kemisk och fysikalisk stabilitet visats under 30 timmar upp till 25 ºC.