Pakkausseloste
YONDELIS kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos 0,25 mg, 1 mg
Yondelis 0,25 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
Yondelis 1 mg kuiva-aine välikonsentraatiksi infuusionestettä varten, liuos
trabektediini
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Yondelis on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät Yondelisia
3. Miten Yondelisia käytetään
4. Mahdolliset haittavaikutukset
5. Yondelisin säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Yondelis sisältää vaikuttavana aineena trabektediinia. Yondelis on syöpälääke, joka estää syöpäsolujen lisääntymistä.
Yondelisia käytetään pitkälle edenneen pehmytkudossarkooman hoitoon, kun aiemmin käytetyt lääkkeet eivät ole tehonneet tai ne eivät sovi potilaalle. Pehmytkudossarkooma on pahanlaatuinen sairaus, joka alkaa jostakin pehmytkudoksesta, esim. lihaksista, rasvakudoksesta tai muista kudoksista (esim. rustoista tai verisuonista).
Yondelisia käytetään yhdessä pegyloidun liposomaalisen doksorubisiinin (PLD, toinen syöpälääke) kanssa munasarjasyövän hoitoon, kun syöpä on uusiutunut vähintään yhden aiemman hoidon jälkeen eikä ole vastustuskykyinen syöpähoidoille, jotka sisältävä platinaseoksia.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä Yondelisia
- jos olet allerginen vaikuttavalle aineelle tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos sinulla on jokin vakava infektio.
- jos imetät.
- jos saat keltakuumerokotuksen.
Varoitukset ja varotoimet
Keskustele lääkärin kanssa ennen kuin käytät Yondelisia.
Yondelisia ja Yondelisin ja PLD:n yhdistelmähoitoa ei saa käyttää, jos sinulla on vaikea maksa-, munuais- tai sydänvaurio.
Kerro lääkärille ennen Yondelis-hoidon aloittamista, jos tiedät tai epäilet, että sinulla on jokin seuraavista:
- Maksa- tai munuaissairauksia.
- Sydänsairauksia tai jos potilashistoriaasi kuuluu sydänsairauksia.
- Vasemman kammion ejektiofraktio (LVEF) on normaalin alarajan alapuolella.
- Sinua on aiemmin hoidettu suurella antrasykliiniannoksella.
Hakeudu välittömästi lääkärin hoitoon, jos jotakin seuraavista ilmenee:
- Sinulle nousee kuume, sillä Yondelis voi aiheuttaa vereen ja maksaan kohdistuvia haittavaikutuksia.
- Sinulla on pahoinvointilääkityksestä huolimatta pahoinvointia tai oksentelua tai et pysty nauttimaan nesteitä, ja sinulta erittyy siksi tavallista vähemmän virtsaa.
- Sinulle kehittyy vaikeaa lihaskipua tai lihasheikkoutta, sillä kyseessä voi olla lihasvaurion merkki (rabdomyolyysi, ks. Kohta Mahdolliset haittavaikutukset).
- Huomaat, että Yondelis-infuusionestettä vuotaa annostelun yhteydessä laskimon ulkopuolelle. Tämä voi aiheuttaa pistoskohdan alueelle soluvaurioita ja kudoskuoliota (kudosnekroosi, ks. myös kohta Mahdolliset haittavaikutukset), jotka saattavat vaatia leikkaushoitoa.
- Jos sinulle tulee allerginen reaktio (yliherkkyys), sinulla voi esiintyä yksi tai useampia seuraavista oireista: kuume, hengitysvaikeudet, ihon punaisuus tai punastelu tai ihottuma, huonovointisuuden tunne (pahoinvointi) tai oksentelu (ks. Kohta Mahdolliset haittavaikutukset).
- Jos havaitset selittämätöntä osittaista tai yleistä turvotusta (ödeemaa), johon saattaa liittyä pyörrytystä, huimausta tai janoa (matala verenpaine). Tämä saattaa olla merkki oireyhtymästä (hiussuonivuoto-oireyhtymä), jossa kudoksiin kerääntyy liiallinen määrä nestettä. Se vaatii lääkärisi välittömän lääketieteellisen arvioinnin.
Lapset ja nuoret
Yondelisia ei saakäyttää alle 18-vuotiaille lapsille, jotka sairastavat lapsuusiän sarkoomia.
Muut lääkevalmisteet ja Yondelis
Kerro lääkärille, jos parhaillaan käytät tai olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Älä käytä Yondelisia, jos saat keltakuumerokotuksen, sillä Yondelisin ja elävää virusta sisältävien rokotteiden samanaikainen käyttö ei ole suositeltavaa. Fenytoiinia sisältävien lääkkeiden (epilepsialääkkeitä) teho voi heiketä, jos niitä käytetään samanaikaisesti Yondelisin kanssa, joten yhdistelmän käyttöä ei suositella.
Jos käytät jotakin seuraavista lääkkeistä Yondelis-hoidon aikan, tilaasi on seurattava huolellisesti, sillä Yondelis-valmisteenvalmisteen vaikutus
- heikentyy (esim. käytettäessä valmisteita, jotka sisältävät rifampisiinia [bakteeri-infektioiden hoitoon], fenobarbitaalia [epilepsialääke] tai mäkikuismaa [Hypericum perforatum, masennuksen hoitoon käytettävä rohdosvalmiste]) tai
- voimistuu (esim. käytettäessä valmisteita, jotka sisältävät ketokonatsolia tai flukonatsolia [sieni-infektioiden hoitoon], ritonaviiria ihmisen immuunikatoviruksen [HIV] hoitoon, klaritromysiiniä [bakteeri-infektioiden hoitoon], aprepitanttia [pahoinvointilääke], siklosporiinia [immuunijärjestelmän toimintaa estävä lääke] tai verapamiilia [korkean verenpaineen tai sydänvaivojen hoitoon]).
Tästä syystä näiden lääkkeiden samanaikaista käyttöä Yondelis-valmisteen kanssa on vältettävä, jos se on mahdollista.
Jos käytät Yondelisia tai Yondelisin ja PLD:n yhdistelmää samanaikaisesti jonkin sellaisen lääkkeen kanssa, joka saattaa aiheuttaa maksa- tai lihasvaurioita (rabdomyolyysi), tilaasi on ehkä seurattava tarkoin, sillä maksa- tai lihasvaurion riski voi suurentua. Esimerkiksi kolesteroliarvojen alentamiseen ja sydän- ja verisuonitautien ehkäisyyn käytettävät statiinivalmisteet voivat aiheuttaa lihasvaurioita.
Yondelis alkoholin kanssa
Alkoholin käyttöä tulee välttää Yondelis-hoidon aikana, sillä se saattaa vahingoittaa maksaa.
Raskaus, imetys ja hedelmällisyys
Raskaus
Yondelisia ei saa käyttää raskauden aikana. Jos olet raskaana, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän lääkkeen käyttöä.
Naisten, jotka voivat tulla raskaaksi, on käytettävä tehokasta ehkäisyä hoidon aikana ja 8 kuukauden ajan sen jälkeen.
Jos raskaus kuitenkin alkaa, kerro siitä välittömästi lääkärille. Perinnöllisyysneuvonta on suositeltavaa, sillä Yondelis saattaa vaurioittaa geeniperimää.
Imetys
Yondelisia ei saa antaa imettäville naisille. Tästä syystä sinun on lopetettava imetys ennen hoidon aloittamista, etkä saa aloittaa imetystä uudelleen ennen kuin lääkäri on vahvistanut, että voit turvallisesti tehdä niin.
Hedelmällisyys
Hedelmällisessä iässä olevien miesten on käytettävä riittävää ehkäisyä Yondelis-hoidon aikana ja 5 kuukauden ajan hoidon lopettamisen jälkeen.
Potilaiden tulee tutustua munasolujen ja siittiöiden säilytysmahdollisuuksiin ennen hoidon aloittamista, sillä Yondelis-hoitoon liittyy korjautumattoman hedelmättömyyden riski.
Perinnöllisyysneuvonta on suositeltavaa myös siinä tapauksessa, että potilas toivoo saavansa lapsia hoidon jälkeen.
Ajaminen ja koneiden käyttö
Yondelis-hoidon aikana voit tuntea olevasi väsynyt ja voimaton. Et saa ajaa autoa etkä käyttää työkaluja etkä koneita, jos sinulla esiintyy tällaisia haittavaikutuksia.
Yondelis sisältää kaliumia
Tämä lääke sisältää kaliumia alle 1 mmol (39 mg) per injektiopullo, eli sen voidaan sanoa olevan ”kaliumiton”.
Miten valmistetta käytetään
Yondelisin antamista valvoo syöpälääkkeiden käyttöön perehtynyt lääkäri. Lääkettä saavat antaa vain syöpätautien erikoislääkärit ja muut terveydenhuollon ammattilaiset, jotka ovat perehtyneet nimenomaan sytotoksisten lääkevalmisteiden antoon.
Pehmytkudossarkooman hoidossa tavanomainen annos on 1,5 mg/m2 kehon pinta-alan mukaan laskettuna. Lääkäri seuraa tilaasi huolellisesti hoitojakson aikana ja päättää, millainen Yondelis-annostus on sinulle sopivin. Japanilaisille potilaille suositeltu annos on kaikkien muiden rotujen tavanomaista annosta pienempi, ja se on 1,2 mg/m2 kehon pinta-alan mukaan laskettuna.
Munasarjasyövän hoidossa tavanomainen annos on 1,1 mg/m2 kehon pinta-alan mukaan laskettuna. Ennen Yondelisia annetaan 30 mg/m2 PLD:tä.
Ennen kuin sinulle annetaan Yondelisia, lääke saatetaan käyttökuntoon ja laimennetaan laskimoon antoa varten. Koko pehmytkudossarkooman hoitoon käytettävän Yondelis-annoksen antaminen laskimoon kestää kullakin annostelukerralla noin 24 tuntia. Jos lääkettä käytetään munasarjasyövän hoitoon, sen annostelu kestää noin 3 tuntia.
Injektiokohdan ärsytyksen välttämiseksi on suositeltavaa, että Yondelis annetaan keskuslaskimokatetrin kautta.
Ennen Yondelis-hoitoa ja tarvittaessa hoidon aikana saat lääkitystä, joka suojaa maksaasi ja vähentää haittavaikutusten kuten pahoinvoinnin ja oksentelun riskiä.
Yondelis-infuusiot annetaan 3 viikon välein. Joskus lääkäri saattaa kuitenkin suositella hoidon siirtämistä, jotta saisit mahdollisimman sopivan annoksen Yondelisia.
Hoitojaksosi kokonaispituus riippuu tilasi kehityksestä ja voinnistasi. Lääkäri kertoo sinulle, kuinka pitkään hoitosi kestää. Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke ja sen yhdistelmä PLD:n kanssa voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Jos et ole varma, mitä seuraavat haittavaikutukset ovat, pyydä lääkäriä selittämään ne sinulle yksityiskohtaisemmin.
Yondelis-hoitoon liittyvät vakavat haittavaikutukset
Hyvin yleiset (useammalla kuin yhdellä potilaalla 10:stä):
- Bilirubiinin (keltainen väriaine) pitoisuus veressäsi saattaa suurentua, mikä saattaa aiheuttaa ihon, limakalvojen ja silmänvalkuaisten keltaisuutta.
- Lääkäri tekee sinulle säännöllisesti verikokeita verimuutosten havaitsemiseksi.
Yleiset (enintään yhdellä potilaalla 10:stä):
- Sinulla saattaa esiintyä veren infektioita (verenmyrkytys), jos immuunijärjestelmäsi on vakavasti heikentynyt. Hakeudu välittömästi lääkärin hoitoon, jos sinulle nousee kuume.
- Sinulla saattaa esiintyä myös lihaskipua (myalgia). Hermovauriot voivat myös aiheuttaa lihaskipua, heikkoutta ja tunnottomuutta. Yleistä turvotusta tai raajojen turvotusta voi esiintyä, ja iholla saattaa tuntua ryömivä tunne.
- Pistoskohtaan voi kehittyä jokin reaktio. Yondelis-infuusionestettä saattaa vuotaa annostelun yhteydessä laskimon ulkopuolelle. Tämä voi aiheuttaa pistoskohdan alueelle soluvaurioita ja kudoskuoliota (kudosnekroosi, ks. myös kohta 2 "Varoitukset ja varotoimet"), jotka saattavat vaatia leikkaushoitoa.
- Voit saada allergisen reaktion. Siinä tapauksessa sinulla voi esiintyä kuumetta, hengitysvaikeuksia, ihon punoitusta tai punastelua tai ihottumaa, huonovointisuuden tunnetta (pahoinvointia) tai oksentelua.
- Kun Yondelis-valmistetta käytetään yhdessä PLD:n kanssa, voit saada pyörtymiskohtauksia. Lisäksi sinusta voi tuntua, että sydämesi lyö liian kovaa tai liian nopeasti (sydämentykytykset), sydämen kammiot saattavat heikentyä (vasemman kammion vajaatoiminta) tai keuhkovaltimo saattaa tukkeutua äkillisesti (keuhkoembolia eli ‑veritulppa).
Melko harvinaiset (enintään yhdellä potilaalla 100:sta):
- Sinulla voi olla voimakasta lihassärkyä ja -kipuja (myalgiaa), jäykkyyttä ja lihasheikkoutta. Sinulla voi esiintyä myös virtsan värin tummentumista. Kaikki edellä mainitut oireet voivat olla merkki lihasvaurioista (rabdomyolyysistä)
- Lääkärisi voi tietyissä tilanteissa vaatia verikokeita, jotta vältetään lihasvaurioiden (rabdomyolyysin) kehittyminen. Erittäin vakavissa tapauksissa tämä voi johtaa munuaisten vajaatoimintaan. Jos koet voimakasta lihaskipua tai -heikkoutta, hakeudu välittömästi lääkärin hoitoon.
- Sinulla voi esiintyä hengitysvaikeuksia, epäsäännöllistä sydämen rytmiä, vähentynyttä virtsaneritystä, äkillisiä mielialan muutoksia, ihoalueiden laikullista punoitusta, erittäin alhaista verenpainetta, johon liittyy epätavallisia laboratoriotutkimusten tuloksia (verihiutaleiden määrän lasku). Hakeudu välittömästi lääkärin hoitoon, jos sinulle kehittyy jokin näistä oireista.
- Keuhkoihin voi kertyä epänormaalisti nestettä, mikä johtaa turvotukseen (keuhkoedeemaan).
- Saatat havaita selittämätöntä osittaista tai yleistä turvotusta (ödeemaa), johon saattaa liittyä pyörrytystä, huimausta tai janoa (matala verenpaine). Tämä saattaa olla merkki oireyhtymästä (hiussuonivuoto-oireyhtymä), jossa kudoksiin kerääntyy liiallinen määrä nestettä. Jos saat näitä oireita tai merkkejä, hakeudu välittömästi lääkärin hoitoon.
- Yondelis-infuusionestettä saattaa vuotaa annon yhteydessä laskimon ulkopuolelle (ekstravasaatio). Sinulla voi silloin esiintyä punoitusta, turvotusta, kutinaa ja epämiellyttävää tunnetta pistoskohdassa. Ilmoita välittömästi sairaanhoitajalle tai lääkärille, jos sinulla ilmenee näitä oireita.
Tämä voi aiheuttaa pistoskohdan alueelle soluvaurioita ja kudoskuoliota (kudosnekroosia), jotka saattavat vaatia leikkaushoitoa.
Jotkin ekstravasaation oireista saattavat näkyä vasta useiden tuntien kuluttua ekstravasaation tapahtumisesta. Sinulla voi esiintyä rakkulamuodostusta, hilseilyä ja pistoskohdan ihon tummumista. Saattaa kestää muutaman päivän, ennen kuin kudosvauriot näkyvät kokonaan. Hakeudu välittömästi lääkärin hoitoon, jos huomaat itselläsi jonkin edellä kuvatuista oireista.
Harvinaiset (enintään yhdellä potilaalla 1 000:sta):
Sinulla voi esiintyä ihon ja silmänvalkuaisten keltaisuutta, kipua vatsan oikealla puolella ylhäällä, pahoinvointia, oksentelua, yleistä huonovointisuutta, keskittymisvaikeuksia, tietämättömyyttä ajasta ja paikasta, sekavuutta sekä uneliaisuutta. Nämä oireet voivat olla merkki maksan vajaatoiminnasta. Hakeudu välittömästi lääkärin hoitoon, jos sinulle kehittyy jokin näistä oireista.
Muut, vähemmän vakavat haittavaikutukset:
Hyvin yleiset (useammalla kuin yhdellä potilaalla 10:stä):
- Sinulla saattaa esiintyä:
- väsymystä
- hengitysvaikeuksia ja yskää
- selkäkipua
- nesteen kertymistä kehoon (turvotus)
- tavallista herkempää mustelmanmuodostusta
- nenäverenvuotoja
- tavallista suurempaa infektioherkkyyttä. Infektio voi myös aiheuttaa lämmönnousua (kuumetta).
Hakeudu välittömästi lääkärin hoitoon, jos sinulle kehittyy jokin näistä oireista.
- Sinulla saattaa olla ruoansulatushäiriöitä, kuten heikentynyt ruokahalu, pahoinvointi, oksentelu, vatsakipu, ripuli tai ummetus. Hakeudu välittömästi lääkärin hoitoon, jos sinulla on pahoinvointilääkkeestä huolimatta edelleen pahoinvointia tai oksentelua tai et pysty nauttimaan nesteitä ja sinulta erittyy siksi tavallista vähemmän virtsaa.
- Sinulla voi esiintyä päänsärkyä.
- Limakalvot saattavat tulehtua, jolloin suun sisäpinta turpoaa ja punoittaa ja siihen muodostuu kivuliaita haavaumia (suutulehdus), tai ruoansulatuskanavan limakalvo tulehtuu käytettäessä Yondelis-valmistetta PLD:n kanssa.
- Potilailla, jotka saavat Yondelis-valmistetta PLD:n kanssa munasarjasyövän hoitoon, voi olla myös jalka-käsioireyhtymä. Se voi ilmetä punoituksena kämmenissä, sormissa ja jalkapohjissa, jotka voivat myöhemmin turvota ja sinertyä. Muutokset voivat joko kuivua ja hilseillä tai muodostaa rakkuloita ja haavaumia.
Yleiset (enintään yhdellä potilaalla 10:stä):
- Sinulla voi esiintyä, nestehukkaa, painonlaskua, ruoansulatusvaivoja ja makuaistin muutoksia.
- Hiustenlähtö on mahdollista.
- Sinulla saattaa olla myös huimausta, verenpaineen alhaisuutta ja punastelua tai ihottumaa.
- Potilailla, jotka saavat Yondelis-valmistetta PLD:n kanssa munasarjasyövän hoitoon, voi esiintyä ihon voimakkaampaa pigmentaatiota.
- Sinulla voi esiintyä nivelkipua.
- Sinulla voi esiintyä nukkumisvaikeuksia.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pakkauksessa ja injektiopullon etiketissä mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2 °C – 8 °C).
Käyttökuntoon saatettujen ja laimennettujen liuosten stabiiliutta koskevat tiedot, ks. hoitoalan ammattilaisille tarkoitettu osa.
Älä käytä tätä lääkettä, jos huomaat siinä näkyviä hiukkasia sekoittamisen tai laimentamisen jälkeen.
Käyttämätön lääkevalmiste tai jäte on hävitettävä sytotoksisia lääkevalmisteita koskevien paikallisten vaatimusten mukaisesti.
Pakkauksen sisältö ja muuta tietoa
Mitä Yondelis sisältää
- Vaikuttava aine on trabektediini. Yondelis 0,25 mg: Yksi injektiopullollinen kuiva-ainetta sisältää 0,25 mg trabektediinia. Yondelis 1 mg: Yksi injektiopullollinen kuiva-ainetta sisältää 1 mg trabektediinia.
- Muut aineet ovat sakkaroosi, kaliumdivetyfosfaatti, fosforihappo (pH:n säätöön) ja kaliumhydroksidi (pH:n säätöön).
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Yondelis on kuiva-aine välikonsentraatiksi infuusionestettä varten. Kuiva-aine on valkoista tai luonnonvalkoista, ja se on pakattu lasiseen injektiopulloon.
Yksi pahvipakkaus sisältää 1 injektiopullon, jossa on joko 0,25 mg tai 1 mg trabektediinia.
Myyntiluvan haltija ja valmistaja
Pharma Mar, S.A.
Avda. de los Reyes 1
Poligono Industrial La Mina
28770 Colmenar Viejo (Madrid)
Espanja
Puh.: +34 91 846 60 00
Fax: +34 91 846 60 01
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltija.
Tämä pakkausseloste on tarkistettu viimeksi 02/2025
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla https://www.ema.europa.eu.
Ohjeet terveydenhuollon ammattilaiselle
Käyttöohjeet – valmistus, käsittely ja hävittäminen
Sytotoksisten lääkevalmisteiden asianmukaista käsittelyä ja hävittämistä koskevia menettelytapoja on noudatettava. Käyttämätön tuote tai jätemateriaali on hävitettävä sytotoksisia lääkevalmisteita koskevien paikallisten vaatimusten mukaisesti.
Yondelis-valmistetta tai Yondelisin ja PLD:n yhdistelmähoitoa käsittelevän henkilöstön tulee saada etukäteen valmisteen asianmukaisia käyttökuntoonsaattamis- ja laimennustekniikkoja koskevaa koulutusta. Käyttökuntoon saattamisen ja laimentamisen aikana on käytettävä suojavaatetusta, johon kuuluu kasvomaski, suojalasit ja käsineet. Jos valmistetta joutuu vahingossa iholle, silmään tai limakalvolle, alue tulee huuhdella välittömästi runsaalla vedellä. Raskaana olevat naiset eivät saa käsitellä valmistetta.
Laskimoinfuusion valmistelu
Yondelis täytyy saattaa käyttökuntoon ja jatkolaimentaa ennen infusointia (ks. myös kohta Miten valmistetta käytetään). Asianmukaista aseptista tekniikkaa tulee noudattaa.
Yondelisia ei saa sekoittaa samaan infuusioon muiden lääkevalmisteiden kuin laimenninliuoksen kanssa. Yondelisin ei ole havaittu olevan yhteensopimaton tyypin I lasipullojen, PVC- tai PE-pussien eikä -letkujen, polyisopreenisäiliöiden eikä implantoitavien titaanisten laskimoporttien kanssa.
Yondelisin ja PLD:n yhdistelmähoitoa käytettäessä infuusioletku tulee huuhdella perusteellisesti 50 mg/ml (5 %) glukoosi-infuusionesteellä PLD-annoksen annostelun jälkeen ja ennen Yondelisin antoa. Muiden laimentimien kuin 50 mg/ml (5 %) glukoosi-infuusionesteen käyttö voi aiheuttaa PLD:n saostumista. (Tarkat käsittelyohjeet, ks. PLD-valmisteen valmisteyhteenveto.)
Käyttö kuntoon saattamisen ohjeet:
Yondelis 0,25 mg: Injektiopulloon injisoidaan 5 ml steriiliä injektionesteisiin käytettävää vettä.
Yondelis 1 mg: Injektiopulloon injisoidaan 20 ml steriiliä injektionesteisiin käytettävää vettä.
Injektiopulloon injisoidaan ruiskulla asianmukainen määrä steriiliä injektionesteisiin käytettävää vettä. Injektiopulloa ravistellaan, kunnes valmiste on täysin liuennut. Käyttökuntoon saatettu liuos on kirkas, väritön tai hieman kellertävä liuos, jossa ei ole käytännössä lainkaan näkyviä hiukkasia.
Käyttökuntoon saatettu liuos sisältää 0,05 mg/ml trabektediinia. Se on jatkolaimennettava, ja sitä tulee käyttää vain yhtä käyttökertaa varten.
Laimennusohjeet:
Käyttökuntoon saatettu liuos tulee laimentaa 9 mg/ml (0,9 %) NaCl-infuusionesteellä tai 50 mg/ml (5 %) glukoosi-infuusionesteellä. Tarvittava määrä lasketaan seuraavasti:
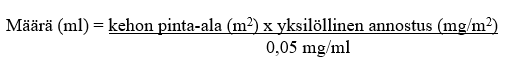
Asianmukainen määrä käyttökuntoon saatettua liuosta vedetään injektiopullosta. Jos valmiste annostellaan laskimoon keskuslaskimokatetrin kautta, käyttökuntoon saatettu liuos lisätään infuusiopussiin, joka sisältää ≥ 50 ml laimenninta (9 mg/ml [0,9 %] NaCl-infuusionestettä tai 50 mg/ml [5 %] glukoosi-infuusionestettä), jolloin infuusionesteen trabektediinipitoisuus on ≤ 0,030 mg/ml.
Jos valmistetta ei voida antaa keskuslaskimoon, vaan on käytettävä perifeeristä laskimoyhteyttä, käyttökuntoon saatettu liuos tulee lisätä infuusiopussiin, joka sisältää ≥ 1 000 ml laimenninta (9 mg/ml [0,9 %] NaCl-infuusionestettä tai 50 mg/ml [5 %] glukoosi-infuusionestettä).
Ennen laskimoon annostelua parenteraalinen liuos tarkistetaan silmämääräisesti näkyvien hiukkasten varalta. Kun infuusioneste on valmisteltu, se tulee antaa välittömästi.
Liuosten käytönaikainen stabiilius:
Käyttökuntoon saatettu liuos
Käyttökuntoon saatetun liuoksen on osoitettu pysyvän kemiallisesti ja fysikaalisesti stabiilina enintään 25 °C lämpötilassa 30 tunnin ajan.
Mikrobiologiselta kannalta käyttökuntoon saatettu liuos tulee laimentaa ja käyttää välittömästi. Jos valmistetta ei laimenneta ja käytetä välittömästi, käyttökuntoon saatetun liuoksen käytönaikaiset säilytysajat ja käyttöä edeltävät säilytysolosuhteet ovat käyttäjän vastuulla ja normaalisti enintään 24 tuntia 2 °C - 8 °C lämpötilassa, ellei käyttökuntoon saattaminen ole tapahtunut kontrolloiduissa ja validoiduissa aseptisissa oloissa.
Laimennettu liuos
Laimennetun liuoksen on osoitettu pysyvän kemiallisesti ja fysikaalisesti stabiilina 30 tunnin ajan enintään 25 °C lämpötilassa.