Pakkausseloste
OCTANINE pulver och vätska till injektionsvätska, lösning 100 IU/ml
Tilläggsinformation
OCTANINE 100 IU/ml, 1000 IU pulver och vätska till injektionsvätska, lösning
Human koagulationsfaktor IX
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du börjar använda detta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare, apotekspersonal eller sjuksköterska.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad OCTANINE är och vad det används för
- Vad du behöver veta innan du använder OCTANINE
- Hur du använder OCTANINE
- Eventuella biverkningar
- Hur OCTANINE ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
OCTANINE tillhör en grupp läkemedel som kallas koagulationsfaktorer och innehåller koagulationsfaktor IX från humant blod. Det är ett speciellt protein som ökar blodets förmåga att levra sig.
OCTANINE används för att behandla eller förebygga blödning hos patienter med blödarsjuka (hemofili B). Det är ett medicinskt tillstånd där blödning kan vara längre än normalt. Detta orsakas av medfödd faktor IX-brist i blodet.
OCTANINE tillhandahålls som pulver och vätska till injektionsvätska, lösning. Efter rekonstitution ges OCTANINE-lösningen intravenöst (injiceras in i en ven).
Vad du behöver veta innan produkten används
Använd inte OCTANINE
- om du är allergisk mot human koagulationsfaktor IX eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar).
- om du har heparininducerad typ II trombocytopeni, som innebär minskning av antalet blodplättar i blodet efter administrering av heparin. Blodplättar är blodceller som hjälper till att få blödning att stanna av. Heparin är ett läkemedel som används för att förebygga blodlevring.
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du använder OCTANINE.
- Liksom med alla läkemedelsprodukter som ges intravenöst och som innehåller proteiner är allergiliknande överkänslighetsreaktioner möjliga. OCTANINE innehåller också mycket små mängder av andra humana proteiner än faktor IX och heparin. Tidiga tecken på överkänslighetsreaktion är:
- nässelutslag
- hudutslag
- tryck över bröstet
- pipande andning
- lågt blodtryck
- en akut, allvarlig allergisk reaktion (anafylaxi när ett eller alla ovan nämnda symtom utvecklas snabbt eller är starkt).
Om dessa symtom förekommer ska injektionen omedelbart avbrytas och läkare kontaktas. I händelse av anafylaktisk chock inleder läkaren rekommenderad behandling så fort som möjligt.
- Din läkare kan rekommendera att du överväger vaccination mot hepatit A och B, om du regelbundet/upprepat får faktor IX-preparat framställda från human plasma.
- Man vet att inhibitorer (neutraliserande antikroppar) mot faktor IX som bildas av lymfocyter kan utvecklas hos patienter med hemofili B. Inhibitorer kan öka risken för anafylaktisk chock (allvarliga allergiska reaktioner). Om du får en allergisk reaktion, bör du testas för förekomsten av inhibitorer. Patienter med inhibitorer mot faktor IX kan ha en ökad risk för anafylaxi om de behandlas med faktor IX. Läkaren kan därför besluta att den första injektionen med faktor IX ges under medicinsk övervakning, då det finns tillgång till tillräcklig medicinsk behandling i fall av allergisk reaktion.
- Faktor IX -proteinkoncentrat kan orsaka en propp i blodkärlen genom en koagel. Denna risk är större vid användning av preparat med lägre renhetsgrad. P.g.a. denna risk bör du följas med tanke på tecken på blodkoagelbildning efter behandling med faktor IX-preparat om:
- du uppvisar tecken på fibrinolys (upplösta blodkoagler)
- du har disseminerad intravaskular koagulation (utbredd blodlevring i blod¬kärlen)
- du har diagnostiserats med en leversjukdom
- du har några kända riskfaktorer för kardiovaskulär sjukdom
- du har nyligen genomgått en operation
- om du har en ökad risk för koagelbildning eller en ökad risk för disseminerad intravaskular koagulation.
Om något av de ovannämnda gäller i ditt fall ger din läkare dig OCTANINE endast om behandlingens nytta är större än dess risker.
- Efter upprepad behandling med humana faktor IX-preparat bör patienter följas med tanke på bildning av neutraliserande antikroppar (inhibitorer). Deras antal bör mätas i Bethesda enheter (BU) med lämplig biologisk testning.
Blodprodukternas virussäkerhet
- När läkemedel framställs av human plasma eller blod, vidtas vissa åtgärder för att förhindra att infektioner överförs till patienter. Dessa åtgärder omfattar noggrant urval av blod- och plasmagivare för att utesluta personer med risk för infektion, samt testning av varje donation och plasmapool för tecken på virus. Tillverkare av dessa produkter inkluderar även steg i processning av blod och plasma med vilka virus kan inaktiveras eller elimineras. Trots dessa åtgärder kan risken för överföring av infektion inte helt uteslutas när läkemedel ges som tillverkats av humant blod eller plasma. Detta gäller även okända eller nya virus eller andra typer av infektioner.
- Dessa åtgärder har visat sig vara effektiva mot höljeförsedda virus, såsom immunbristvirus (HIV), hepatit B- och hepatit C-virus och mot icke-höljeförsett hepatit A-virus. Åtgärderna har endast begränsad effekt mot icke-höljeförsedda virus såsom parvovirus B19. Infektion med parvovirus B19 kan vara allvarlig för gravida kvinnor (infektion av foster), och för individer som har försämrat immunförsvar eller någon typ av anemi (t.ex. sicklecellanemi eller hemolytisk anemi).
Det är högst rekommenderat att produktnamn och tillverkningssatsnummer registreras varje gång du får en OCTANINE-dos för att kunna upprätthålla ett register över de tillverkningssatser som använts.
Barn
Om OCTANINE ges till nyfödda, bör tecken på disseminerad intravaskular koagulation följas noga.
Andra läkemedel och OCTANINE
- Inga interaktioner mellan human blodkoagulationsfaktor IX-produkter och andra läkemedel är kända.
Tala om för läkare eller apotekspersonal om du tar, nyligen har tagit eller kan tänkas ta andra läkemedel.
Graviditet och amning
Det finns ingen erfarenhet av användning av faktor IX under graviditet eller amning. Faktor IX bör därför endast användas under graviditet och amning om det är klart nödvändigt.
Rådfråga läkare eller apotekspersonal innan du tar något läkemedel.
Körförmåga och användning av maskiner
Ingen påverkan på körförmåga och användning av maskiner har observerats.
OCTANINE innehåller natrium
Detta läkemedel innehåller upp till 138 mg natrium (huvudkomponenten i bordsalt) i en injektionsflaska OCTANINE 1000 IE vilket motsvarar 6,9 % av högsta rekommenderade intag av natrium för en vuxen. Detta bör du ta i beaktande om du har ordinerats en natriumfattig kost.
Hur produkten används
Ta alltid detta läkemedel enligt läkarens anvisningar. Rådfråga läkare eller apotekspersonal om du är osäker.
OCTANINE ges intravenöst (injiceras in i en ven) efter rekonstitution med injektionsvätska.
Använd endast bifogade infusionshjälpmedel. Användning av andra injektions/infusionshjälpmedel kan innebära ökade risker och leda till misslyckad behandling.
Behandlingen bör inledas under övervakning av en läkare insatt i behandling av hemofili. Hur mycket OCTANINE du ska ta och hur länge substitutionsbehandlingen pågår beror på svårighetsgraden av din faktor IX-brist. Det beror också på var det blöder och hur svår blödningen är samt på ditt kliniska tillstånd.
Beräkning av dosen:
Läkaren talar om för dig hur ofta och hur mycket OCTANINE du ska injicera.
Faktor IX-dosen uttrycks i internationella enheter (IU). Faktor IX-aktivitet i plasma motsvarar mängden av faktor IX i plasma. Den anges antingen som procent (jämfört med normal humanplasma) eller som internationella enheter (jämfört med en internationell standard för faktor IX i plasma).
En internationell enhet (IU) av faktor IX-aktivitet motsvarar faktor IX-mängden i en milliliter normal human blodplasma. Beräkning av den dos faktor IX som krävs är baserad på observationer som visar att 1 IU faktor IX per kg kroppsvikt ökar plasmafaktor IX-aktiviteten med 1 %. För att beräkna den dos som du behöver mäts faktor IX-aktiviteten i din blodplasma. Det visar hur mycket aktiviteten behöver ökas.
Dosen som behövs beräknas enligt följande formel:
Enheter som krävs = kroppsvikt (kg) x önskad faktor IX-ökning (%) (IU/dl) x 0,8
Dosen som behövs och hur ofta den ska ges beror på hur du reagerar på läkemedlet, och det bestäms av din läkare. Koagulationsfaktor IX behöver endast sällan ges oftare än en gång per dag.
Eftersom din respons på faktor IX kan variera, ska dosmängden och hur ofta den ska ges vara baserad på mätning av dina faktor IX -halter under behandlingsperioden. Särskilt vid operationer använder sig läkaren av blodtester (plasmafaktor IX-aktivitet) för noggrann övervakning av substitutionsbehandlingen.
Förebyggande av blödning:
Om du har svår hemofili B ska du injicera 20-40 IU faktor IX per kg kroppsvikt. Vid långtidsprofylax ska du dosera denna dos två gånger i veckan. Dosen ska justeras enligt din respons. I vissa fall, i synnerhet hos yngre patienter, kan kortare doseringsintervaller och större doser vara nödvändiga.
Användning för barn
I en studie med barn under 6 år var dosen som doserades per behandlingsdag i genomsnitt 40 IU/kg kroppsvikt.
Om blödning inte går att stoppa p.g.a. inhibitorer:
Informera läkaren om förväntad faktor IX-aktivitet inte uppnås efter injektion, eller om blödningen inte stannar efter korrekt dos. Läkaren undersöker din blodplasma för att se om du har utvecklat inhibitorer (antikroppar) mot faktor IX-protein. Dessa inhibitorer kan minska faktor IX-aktiviteten. I så fall kan det vara nödvändigt att välja en annan behandling. Läkaren diskuterar detta med dig och rekommenderar vid behov fortsatt behandling.
Om du har tagit för stor mängd av OCTANINE
Inga symtom på överdosering har rapporterats för human koagulationsfaktor IX. Den rekommenderade dosen bör dock inte överskridas.
För instruktioner för behandling hemma, se apparaturförpackningens kartong.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar, men alla användare behöver inte få dem.
- Överkänslighetsreaktioner eller allergiska reaktioner har i sällsynta fall konstaterats hos patienter som behandlats med produkter som innehåller faktor IX. Dessa kan innebära:
- ofrivilliga blodkärlsspasmer, som är förknippade med svullnad i ansikte, mun och hals
- brännande och svidande vid infusionsstället
- frossbrytningar
- värmekänsla
- hudutslag
- huvudvärk
- nässelutslag
- lågt blodtryck
- dåsighet
- illamående
- oro
- snabba hjärtslag
- tryck över bröstet
- stickningar
- kräkningar
- pipande andning.
I vissa fall kan dessa allergiska reaktioner leda till en allvarlig reaktion som kallas anafylaxi. Anafylaxi kan vara förknippad med chock. Dessa reaktioner är främst associerade med bildning av faktor IX-inhibitorer. Om du har något av de symtom som nämns ovan, kontakta läkare.
- Om du har hemofili B, kan du utveckla neutraliserande antikroppar (inhibitorer) mot faktor IX. Dessa inhibitorer kan hindra läkemedlet att fungera som det ska. Läkaren diskuterar detta med dig och rekommenderar vid behov fortsatt behandling.
I en studie med 25 barn med hemofili B, sex av vilka inte hade behandlats tidigare, konstaterades inga inhibitorer under studien. Injektionernas tolerabilitet uppskattades vara god eller mycket god.
- Några patienter med hemofili B som hade faktor IX-inhibitorer och som behandlades med immunresponsbehandling och som fick en allergisk reaktion utvecklade nefrotiskt syndrom (en svår njursjukdom).
- Feber kan förekomma i sällsynta fall.
- Faktor IX-produkter med låg renhet kan i sällsynta fall orsaka en blodkoagel i ett blodkärl. Detta kan leda till någon av följande komplikationer:
- hjärtinfarkt
- utbredd koagulation i blodkärlen (disseminerad intravaskulär koagulation)
- blodkoagler i venerna (ventrombos)
- blodkoagler i lungorna (lungemboli).
Dessa biverkningar är vanligare om du använder faktor IX-produkter med låg renhet, och de förekommer endast sällan om du använder produkter med hög renhet, såsom OCTANINE.
- Produkten innehåller heparin, som kan orsaka plötslig minskning av antalet blodplättar under 100 000/mikroliter eller under 50 % av det ursprungliga antalet. Denna allergiska reaktion kallas ”heparininducerad typ II trombocytopeni”. I sällsynta fall kan denna minskning av antalet blodplättar inträffa 6-14 dagar efter behandlingens början hos patienter som inte tidigare varit överkänsliga mot heparin. Hos patienter med tidigare heparinöverkänslighet kan förändringen utvecklas inom några timmar efter att behandlingen inletts.
Denna mer svårartade minskning av antalet blodkroppar kan vara förknippad med eller resultera i:
- blodkoagler i artärer och vener
- tilltäppning av blodkärl p.g.a. en tromb som bildats på annat ställe
- svår störning av blodlevring som kallas konsumptiv koagulopati
- hudnekros vid injektionsstället
- blödning som liknar loppbett
- purpurfärgade blånader
- tjärig avföring.
Om du observerar dessa allergiska reaktioner sluta omedelbart injektioner med OCTANINE och använd inte i fortsättningen produkter som innehåller heparin.
På grund av denna sällsynta effekt på blodplättarna följer läkaren antalet blodplättar, i synnerhet i början av behandlingen.
För information om säkerhet av överförda produkter, se punkt 2 (Varningar och försiktighet).
Om du får biverkningar, tala med läkare, apotekspersonal eller sjuksköterska. Detta gäller även eventuella biverkningar som inte nämns i denna information.
Rapportering av biverkningar
Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
webbplats: www.fimea.fi
Säkerhets‐ och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn- och räckhåll för barn.
Förvaras vid högst 25 °C.
Får ej frysas.
Förvara injektionsflaskorna i ytterkartongen. Ljuskänsligt.
Används före utgångsdatum som anges på etiketten och kartongen. Utgångsdatumet är den sista dagen i angiven månad.
Den rekonstituerade produkten bör användas omedelbart, eller åtminstone inom 8 timmar med förvaring vid rumstemperatur (25 °C).
Använd OCTANINE vid endast ett tillfälle.
Använd inte detta läkemedel om du märker att det är grumligt eller om pulvret inte är helt upplöst.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
Den aktiva substansen är human koagulationsfaktor IX.
Övriga innehållsämnen är heparin, natriumklorid, natriumcitrat, argininhydroklorid och lysinhydroklorid.
Läkemedlets utseende och förpackningsstorlekar
- OCTANINE 100 IU/ml, 1000 IU tillhandahålls som pulver och vätska till injektionsvätska; en injektionsflaska innehåller nominellt 1000 IU human koagulationsfaktor IX.
Produkten innehåller ca 100 IU/ml human koagulationsfaktor IX efter rekonstitution med 10 ml vatten till injektion.
OCTANINE tillverkas av human blodplasma.
Effekt (IU) bestäms med hjälp av Europeiska farmakopéns koagulationstest, jämfört med Världshälsoorganisationens (WHO) internationella standard. Den specifika aktiviteten av OCTANINE är cirka 100 IU/mg protein.
Beskrivning av förpackningen:
OCTANINE säljs som kombinationsförpackning, som består av två pappkartonger som hålls ihop med plastfilm:
1 pappkartong innehåller en injektionsflaska med pulver till injektionsvätska, lösning, samt bipacksedel.
Den andra pappkartongen innehåller en injektionsflaska med lösningsmedel (vatten till injektion);
10 ml för OCTANINE 100 IU/ml, 1000 IU.
Förpackningen innehåller också följande hälsovårdsutrustning:
- 1 förpackning med utrustning för intravenös injektion (1 överföringsset, 1 infusionsset, 1 engångsspruta)
- 2 spritservetter.
Innehavare av godkännande för försäljning och tillverkare
Innehavare av godkännande för försäljning:
Octapharma AB
SE-112 75 Stockholm
Sverige
Tillverkare:
Octapharma Pharmazeutika Produktionsges.m.b.H
Oberlaaer Strasse 235
A-1100 Wien
Österrike
eller
Octapharma S.A.S.
70-72 Rue du Maréchal Foch
67380 Lingolsheim
Frankrike
Ytterligare upplysningar om detta läkemedel kan erhållas hos den nationella representanten för innehavare av godkännandet för försäljning.
Octapharma Nordic AB
Råtorpsvägen 41 C
01640 Vanda
Denna bipacksedel ändrades senast 8.3.2021.
Direktiv för användaren
Instruktioner för hemvård
• Läs noga igenom alla anvisningar och följ dem noggrant!
• Använd inte OCTANINE efter utgångsdatumet som står på etiketten och kartongen.
• Sterilitet måste upprätthållas under proceduren som beskrivs nedan.
• Berett läkemedel ska inspekteras visuellt med avseende på partiklar och missfärgning före administrering.
• Lösningen i sprutan skall vara klar eller svagt opaliserande (mjölkig). Injicera inte lösningen om den är grumlig eller har fällning.
• Använd den rekonstituerade lösningen omedelbart för att undvika mikrobiell kontamination.
• Använd enbart det medföljande infusionshjälpmedel. Används andra injektions/infusionsredskap så kan det öka risken och förorsaka misslyckad behandling.
Anvisningar för färdigberedning av lösningen:
- Använd inte produkten direkt efter att den tagits ut ur kylskåpet. Låt spädningsvätskan och pulvret i de oöppnade injektionsflaskorna anta rumstemperatur.
- Ta bort kapsylerna från båda flaskorna och tvätta gummipropparna med en av de bipackade desinfektionstorkarna.
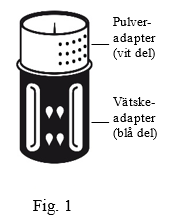
- Överföringssetet avbildas i Fig 1. Placera injektionsflaskan med spädningsvätska på en plan yta och håll den stadigt. Ta överföringssetet och vänd den upp och ned. Sätt den blå delen av överföringssetet på flaskan med spädningsvätska och tryck bestämt tills det klickar (Fig 2+3). Vrid inte medan du ansluter.
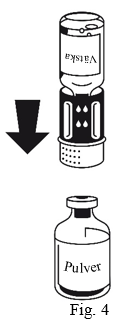
- Placera injektionsflaskan med pulvret på en plan yta och håll den stadigt. Ta injektionsflaskan med spädningsvätska med det anslutna överföringssetet och vänd den upp och ned. Sätt den vita delen på pulverflaskans propp och tryck bestämt tills det klickar (Fig.4). Vrid inte medan du ansluter. Vätskan rinner automatiskt över till pulverflaskan.
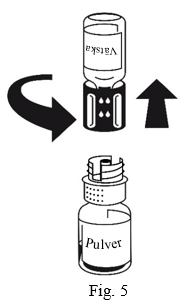
- Rotera pulverflaskan långsamt med båda flaskorna anslutna tills pulvret löst sig. Pulvret löser sig på mindre än 10 minuter vid rumstemperatur. Lätt skumbildning kan förekomma under upplösningen. Skruva isär överföringssetet i två delar (Fig.5). Då försvinner skummet.
Kassera vätskeflaskan med den blå delen av överföringssetet fastsatt.


Anvisningar för injektion:
Som en försiktighetsåtgärd ska din puls tas före och under injektionen. Om pulsen stiger markant ska injektionshastigheten reduceras eller administrationen tillfälligt avbrytas.
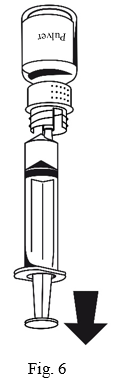
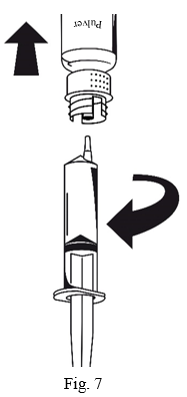
- Anslut sprutan till den vita delen av överföringssetet. Vänd flaskan upp och ned och drag upp lösningen i sprutan (Fig.6). Lösningen ska vara klar eller svagt opalieserande. När lösningen har överförts, håll stadigt i sprutans kolv (med kolven nedåt) och avlägsna sprutan från överföringssetet (Fig.7). Kassera den tomma flaskan tillsammans med den vita delen av överföringssetet.
- Rengör det valda injektionsstället med en av de bipackade desinfektionstorkarna.
- Anslut det bipackade infusionssetet till sprutan.
- Stick in injektionsnålen i den valda venen. Om du har använt stasband för att lättare se venen, bör detta öppnas innan du påbörjar injektionen av OCTANINE. Blod får inte komma in i sprutan på grund av risken för koagelbildning.
- Injicera lösningen långsamt i venen, ej mer än 2-3 ml per minut.
Om du använder mer än en flaska OCTANINE-pulver vid samma behandlingstillfälle kan samma injektionsnål och spruta användas. Överföringssetet är endast för engångsbruk.
Ej använt läkemedel och avfall ska kasseras enligt gällande anvisningar.