Pakkausseloste
LUMIGAN silmätipat, liuos 0,3 mg/ml
LUMIGAN 0,3 mg/ml, silmätipat, liuos
bimatoprosti
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä LUMIGAN on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin käytät LUMIGAN-valmistetta
3. Miten LUMIGAN-valmistetta käytetään
4. Mahdolliset haittavaikutukset
5. LUMIGAN-valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
LUMIGAN on glaukoomalääke, ja se kuuluu prostamideiksi kutsuttujen lääkeaineiden ryhmään.
LUMIGAN-silmätippoja käytetään silmänsisäisen paineen alentamiseen. Sitä voidaan käyttää yksin tai yhdessä toisten silmänsisäistä painetta alentavien tippojen, beetasalpaajien, kanssa.
Silmissä on kirkasta ja vetistä nestettä, joka ruokkii silmän sisäosia. Tätä nestettä virtaa jatkuvasti ulos silmästä ja uutta nestettä valmistuu sen tilalle. Jos neste ei pääse virtaamaan ulos tarpeeksi nopeasti, silmänsisäinen paine nousee. Tämä lääke lisää ulosvirtaavan nesteen määrää, mikä alentaa silmänsisäistä painetta. Jos painetta ei alenneta, se saattaa johtaa glaukooma-nimiseen sairauteen ja lopulta heikentää näköä.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä LUMIGAN-valmistetta:
- jos olet allerginen bimatoprostille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
- jos olet joutunut aiemmin lopettamaan silmätippojen käytön, koska sait säilytysaineena käytetystä bentsalkoniumkloridista haittavaikutuksen.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin käytät LUMIGAN-valmistetta, jos:
- sinulla on hengitysvaikeuksia.
- maksasi tai munuaisesi toimivat huonosti.
- sinulle on aiemmin tehty kaihileikkaus.
- silmäsi ovat hyvin kuivat.
- sinulla on parhaillaan tai ollut aiemmin ongelmia sarveiskalvon kanssa (silmän etuosan läpinäkyvä kerros).
- käytät piilolinssejä (katso ”LUMIGAN sisältää bentsalkoniumkloridia”).
- sinulla on parhaillaan tai ollut aiemmin matala verenpaine tai matala syke.
- sinulla on ollut silmässä virusinfektio tai tulehdus.
Hoidon aikana LUMIGAN saattaa aiheuttaa silmän ympärillä olevan rasvatyynyn ohenemista, minkä vuoksi luomivako saattaa syventyä, silmä voi painua kuoppaansa (enoftalmia), yläluomi voi riippua (ptoosi), silmänympärysiho voi kiristyä (velton ihon surkastuminen) tai silmän valkuaisen alaosa voi tulla selvemmin esiin (kovakalvon alaosan näkyminen). Muutokset ovat tyypillisesti lieviä, mutta näkyvämmät muutokset voivat vaikuttaa näkökenttään. Muutokset voivat hävitä, jos lopetat LUMIGAN-valmisteen ottamisen. LUMIGAN saattaa myös aiheuttaa ripsien kasvua ja värin tummumista sekä silmäluomen ympärillä olevan ihon tummumista. Myös silmän värikalvo saattaa tummua. Nämä muutokset saattavat olla pysyviä. Muutokset saattavat olla näkyvämpiä, jos hoidat vain toista silmää.
Lapset ja nuoret
LUMIGANia ei ole testattu alle 18-vuotiailla lapsilla ja nuorilla ja siten alle 18-vuotiaat eivät saa käyttää LUMIGANia.
Muut lääkevalmisteet ja LUMIGAN
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan otat, olet äskettäin ottanut tai saatat ottaa muita lääkkeitä.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
LUMIGAN saattaa erittyä äidinmaitoon. Imettämistä ei suositella LUMIGAN-hoidon aikana.
Ajaminen ja koneiden käyttö
Näkökykysi saattaa sumentua tilapäisesti, kun olet tiputtanut LUMIGANia silmään. Ennen ajamista tai koneiden käyttöä on odotettava näön selkenemistä.
LUMIGAN sisältää bentsalkoniumkloridia
Tämä lääkevalmiste sisältää bentsalkoniumkloridia 0,15 mg per 3 ml liuosta, mikä vastaa 0,05 mg:aa/ml.
Älä käytä silmätippoja käyttäessäsi piilolinssejä. LUMIGAN sisältää säilytysaineena bentsalkoniumkloridia, joka saattaa imeytyä pehmeisiin piilolinsseihin ja voi muuttaa niiden väriä. Poista piilolinssit ennen tämän lääkevalmisteen käyttöä ja laita piilolinssit takaisin 15 minuutin kuluttua.
Bentsalkoniumkloridi voi myös aiheuttaa silmä-ärsytystä erityisesti, jos sinulla on kuivat silmät tai sarveiskalvon sairauksia (silmän etuosan läpinäkyvä kerros). Jos silmääsi tulee poikkeavaa tunnetta, pistelyä tai kipua tämän lääkkeen käytön jälkeen, keskustele asiasta lääkärisi kanssa.
Miten valmistetta käytetään
Käytä tätä lääkettä juuri siten kuin lääkäri on määrännyt tai apteekkihenkilökunta on neuvonut. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
LUMIGAN annostellaan silmään. Suositeltu LUMIGAN-annos on yksi tippa illalla kumpaankin hoitoa tarvitsevaan silmään kerran päivässä.
Jos käytät LUMIGANia muiden silmälääkkeiden kanssa, odota eri silmälääkkeiden annostelun välillä vähintään 5 minuuttia.
Älä käytä useammin kuin kerran päivässä, sillä hoidon teho voi heikentyä.
Käyttöohjeet:
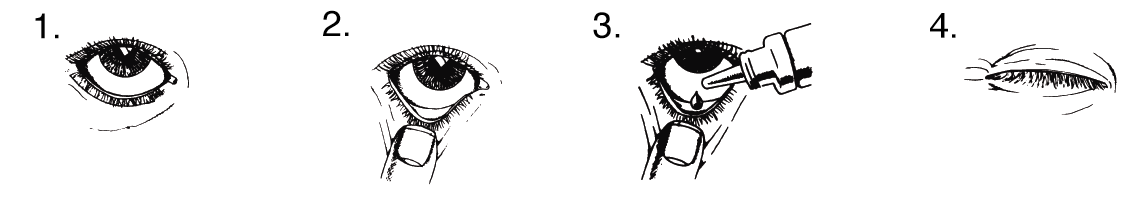 Älä käytä pulloa, jos pullonkaulan suojasinetti on rikottu ennen kuin käytät valmistetta ensimmäisen kerran.
Älä käytä pulloa, jos pullonkaulan suojasinetti on rikottu ennen kuin käytät valmistetta ensimmäisen kerran.
- Pese kätesi. Kallista päätäsi taaksepäin ja kohdista katseesi kattoon.
- Vedä alaluomea varovasti alaspäin, kunnes siihen muodostuu pieni tasku.
- Käännä pullo ylösalaisin ja purista hoitoa tarvitsevaan silmään yksi tippa.
- Irrota otteesi alaluomesta ja sulje silmä 30 sekunniksi.
Pyyhi pois mahdollinen poskelle valuva ylimääräinen liuos.
Jos tippa ei osu silmään, yritä uudelleen.
Tulehduksia ja silmävammoja välttääksesi älä anna pullon tiputuskärjen koskea silmään tai muuhun pintaan. Pane pullon korkki paikoilleen ja sulje pullo heti käytön jälkeen.
Jos käytät enemmän LUMIGAN-valmistetta kuin sinun pitäisi
Jos käytät LUMIGANia enemmän kuin pitäisi, on epätodennäköistä, että siitä koituu sinulle mitään vahinkoa. Tiputa seuraava annos normaaliin aikaan. Jos olet asiasta huolestunut, neuvottele siitä lääkärisi tai apteekin kanssa.
Jos unohdat käyttää LUMIGAN-valmistetta
Jos unohdat käyttää LUMIGANia, laita yksi tippa silmään heti kun muistat ja palaa sitten normaaliin annosteluun. Älä tiputa kaksinkertaista annosta korvataksesi unohtamasi annoksen.
Jos lopetat LUMIGAN-valmisteen käytön
LUMIGANia tulisi käyttää joka päivä, jotta se vaikuttaa asianmukaisesti. Jos lopetat LUMIGANin käytön, silmänpaineesi saattaa nousta. Tämän takia sinun on puhuttava lääkärisi kanssa ennen tämän hoidon lopettamista.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Hyvin yleiset (voi esiintyä useammalla kuin 1 henkilöllä 10:stä)
Silmät
- Pidentyneet silmäripset (enintään 45 %:lla potilaista)
- Lievä punoitus (enintään 44 %:lla potilaista)
- Kutina (enintään 14 %:lla potilaista)
- Silmän alueen rasvatyynyn oheneminen, mistä voi seurata luomivaon syventyminen, silmän painuminen kuoppaansa (enoftalmia), riippuva yläluomi (ptoosi), silmänympärysihon kiristyminen (velton ihon surkastuminen) tai silmän valkuaisen alaosan tuleminen selvemmin esiin (kovakalvon alaosan näkyminen)
Yleiset (voi esiintyä enintään 1 henkilöllä 10:stä)
Silmät
- Silmän allerginen reaktio
- Silmien väsyminen
- Valolle herkistyminen
- Silmää ympäröivän ihon tummuminen
- Ripsien tummuminen
- Kipu
- Roskantunne silmässä
- Rähmäisyys
- Värikalvon tummuminen
- Näön sumeneminen
- Silmän ärsytys
- Silmien kirveleminen
- Tulehtuneet, punaiset ja kutiavat silmäluomet
- Kyyneleritys
- Silmien kuivuminen
- Näön heikkeneminen
- Sumentunut näkö
- Silmän sidekalvon turvotus
- Pieniä haavaumia silmän pinnassa, joihin voi liittyä tulehdusta
Elimistö
- Päänsärky
- Kohonneet maksan toimintakoearvot
- Kohonnut verenpaine
Melko harvinaiset (voi esiintyä enintään 1 henkilöllä 100:sta)
Silmät
- Kystoidi makulaedeema (silmän verkkokalvon turpoaminen, joka johtaa näön heikentymiseen)
- Silmätulehdus
- Verkkokalvon verenvuoto
- Turvonneet silmäluomet
- Silmäluomen nykiminen
- Silmäluomen kutistuminen, siirtyminen poispäin silmän pinnasta
- Silmiä ympäröivän ihon punoitus
Elimistö
- Pahoinvointi
- Heitehuimaus
- Heikotus
- Karvojen kasvu silmien ympärillä
Tuntemattomat (saatavissa oleva tieto ei riitä esiintyvyyden arviointiin)
Silmät
- Epämiellyttävä tunne silmässä
Elimistö
- Astma
- Astman paheneminen
- Keuhkoahtaumataudin (COPD) paheneminen
- Hengenahdistus
- Allergisen reaktion oireet (turvotus, silmien punoitus ja ihottuma)
- Ihon värimuutokset (silmänympärysihon)
Muita fosfaattia sisältävien silmätippojen käytön yhteydessä raportoituja haittavaikutuksia.
Jos sinulla on vakava vaurio silmän etuosan läpinäkyvässä kerroksessa (sarveiskalvossa), fosfaatit voivat hyvin harvinaisissa tapauksissa aiheuttaa sameita laikkuja sarveiskalvoon johtuen kalsiumin kertymisestä hoidon aikana.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä pullossa ja pakkauksessa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
LUMIGAN-pullo on hävitettävä viimeistään, kun sen avaamisesta on kulunut neljä viikkoa, vaikka tippoja olisi vielä jäljellä. Tämä käytäntö ehkäisee tulehduksia. Jotta muistaisit toimia näin, kirjoita avaamispäivämäärä pahvikoteloon sille merkittyyn kohtaan.
Lääkkeitä ei pidä heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä LUMIGAN sisältää
- Vaikuttava aine on bimatoprosti. Yksi millilitra liuosta sisältää 0,3 mg bimatoprostia.
- Muut aineet ovat bentsalkoniumkloridi (säilytysaine), natriumkloridi, dinatriumfosfaattiheptahydraatti, sitruunahappomonohydraatti ja puhdistettu vesi. Liuokseen on voitu lisätä pieniä määriä suolahappoa tai natriumhydroksidia happamuuden (pH-arvon) pitämiseksi normaalina (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä).
Lääkevalmisteen kuvaus ja pakkauskoot
LUMIGAN on väritön, kirkas silmätippaliuos. Pakkauksessa on joko 1 tai 3 kierrekorkillista muovipulloa. Kukin pullo on täytetty noin puoliväliin ja sisältää kolme millilitraa liuosta. Tämä riittää 4 viikoksi. Kaikkia pakkauskokoja ei välttämättä ole myynnissä.
Myyntiluvan haltija
AbbVie Deutschland GmbH & Co. KG
Knollstrasse
67061 Ludwigshafen
Saksa
Valmistaja
Allergan Pharmaceuticals Ireland
Castlebar Road
Westport
Co. Mayo
Irlanti
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi AbbVie Oy Puh: +358 (0)10 2411 200 |
Tämä pakkausseloste on tarkistettu viimeksi 11/2024
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla https://www.ema.europa.eu.
Jos haluat kuunnella tämän pakkausselosteen tai pyytää siitä kopion isotekstisenä, ota yhteys myyntiluvan haltijan paikalliseen edustajaan.