Pakkausseloste
SONOVUE pulver och vätska till injektionsvätska, dispersion 8 mikrol/ml
Tilläggsinformation
SonoVue, mikrobubblor 8 mikroliter/mL, pulver och vätska till injektionsvätska, dispersion
svavelhexafluorid
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du fårdetta läkemedel. Den innehåller information som är viktig för dig.
- Spara denna information, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till din läkare eller apotekspersonal.
- Detta läkemedel har ordinerats enbart åt dig. Ge det inte till andra. Det kan skada dem, även om de uppvisar sjukdomstecken som liknar dina.
- Om du får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
- Vad SonoVue är och vad det används för
- Vad du behöver veta innan du får SonoVue
- Hur du fårSonoVue
- Eventuella biverkningar
- Hur SonoVue ska förvaras
- Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
SonoVue är endast avsett för diagnostisk användning.
SonoVue är ett kontrastmedel för ultraljudsundersökning som innehåller små bubblor fyllda med en gas som heter svavelhexafluorid.
Om du är vuxen används SonoVue för att ge tydligare ultraljudsbilder av ditt hjärta, dina blodkärl och/eller vävnad i lever och bröst.
SonoVue ger tydligare bilder av urinvägarna hos barn.
Vad du behöver veta innan produkten används
Använd inte SonoVue:
- om du är allergisk mot svavelhexafluorid eller något annat innehållsämne i detta läkemedel (anges i avsnitt Förpackningens innehåll och övriga upplysningar),
- om du har en höger‑vänstershunt i hjärtat (onormal blodpassage i hjärtat),
- om du har allvarlig lunghypertoni (förhöjt lungartärtryck > 90mmHg),
- om du har okontrollerat högt blodtryck,
- om du har andnödssyndrom (ett allvarligt sjukdomstillstånd med med omfattande inflammation i lungorna),
- om du har blivit tillsagd att inte ta dobutamin (läkemedel som stimulerar hjärtat) pga. av din allvarliga hjärtsjukdom.
Varningar och försiktighet
Berätta för din läkare om du under de två sista dagarna har:
- haft täta eller återkommande attacker av kärlkramp i hjärtat eller smärtor i bröstet, särskilt om du har hjärtsjukdom i din sjukdomshistoria,
- haft nyligen tillkomna EKG‑förändringar.
Tala med läkare innan du får SonoVue om:
- du nyligen har haft en hjärtinfarkt eller genomgått kranskärlskirurgi,
- du har kärlkramp, smärtor i bröstet eller allvarlig hjärtsjukdom,
- du har en allvarlig hjärtrytmrubbning,
- din hjärtsjukdom nyligen förvärrats,
- du har en akut inflammation i hjärtats innerhinna (endokardit),
- du har en inopererad konstgjord hjärtklaff,
- du har en akut allmän inflammation eller infektion,
- du har en störning i blodets förmåga att levra sig,
- du har en allvarlig njur‑ eller leversjukdom,
Om du får SonoVue tillsammans med ett läkemedel, en fysisk aktivitet eller en medicinteknisk produkt som stimulerar hjärtat för att kunna avbilda hjärtat under belastning kommer hjärtaktivitet, blodtryck och hjärtrytm att övervakas.
SonoVue innehåller makrogol, ett innehållsämne som också kallas polyetylenglykol (PEG). Fall av allvarliga allergiska reaktioner har rapporterats. Det kan finnas en ökad risk för allvarliga reaktioner hos patienter som tidigare har fått allergiska reaktioner av PEG. Informera läkaren om du tidigare har fått en allergisk reaktion av PEG-innehållande produkter.
Du kommer att hållas under noggrann övervakning under minst 30 minuter efter injektionen av SonoVue, för att övervaka risken för allvarliga allergiska reaktioner.
Barn och ungdomar
För patienter under 18 år kan SonoVue endast användas för ultraljud av urinvägarna.
Andra läkemedel och SonoVue
Tala om för läkare om du använder, nyligen har använt eller kan tänkas använda andra läkemedel. Det är särskilt viktigt att du talar om för läkaren om du tar betablockerare (läkemedel mot hjärtsjukdom och högt blodtryck eller ögondroppar mot grön starr).
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare innan du får detta läkemedel.
Det är inte känt om SonoVue passerar över i bröstmjölk. Du ska dock inte amma inom två till tretimmar efter ultraljudsundersökningen.
Körförmåga och användning av maskiner
SonoVue påverkar inte förmågan att köra bil och använda maskiner.
SonoVue innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol natrium (23 mg) per dos, d.v.s. är i det närmaste ”natriumfri”.
Hur produkten används
SonoVue ges av läkare eller sjukvårdspersonal med erfarenhet av den här sortens undersökning.
För ultraljud av hjärta eller blodkärl och/eller vävnader i lever och bröst hos vuxna, ska dosen som administreras i en ven räknas ut åt dig beroende på vilken kroppsdel som skall undersökas. Rekommenderad dos är 2 eller 2,4 mL per patient. Denna dos kan upprepas. Vid behov kan dosen upprepas till 4,8 mL.
För ultraljud av urinvägarna hos barn rekommenderas att dosen 1 mL per patient administreras i urinblåsan på följande sätt:
Efter tömning av urinblåsan introduceras en saltlösning i urinblåsan genom en tunn slang. SonoVue administreras sedan genom den tunna slangen och efterföljs av administrering av saltlösning för att fortsätta fylla urinblåsan. Fyllning och tömning av urinblåsan med saltlösning kan upprepas vid behov.
Om du har ett allvarligt lung- eller hjärtproblem kommer du att övervakas noga under och minst 30 minuter efter injektionen av SonoVue.
Om du får för stor mängd av SonoVue
Det är inte sannolikt att du får en överdos eftersom SonoVue ges av en läkare. I händelse av överdosering kommer läkaren att vidta lämpliga åtgärder.
Eventuella biverkningar
Liksom alla läkemedel kan detta läkemedel orsaka biverkningar men alla användare behöver inte få dem.
De flesta biverkningar av SonoVue är sällsynta och vanligvis inte allvarliga. Vissa patienter kan emellertid uppleva allvarliga biverkningar som kan kräva behandling.
Informera genast din läkare om du noterar någon av följande biverkningar - du kan behöva medicinsk behandling: svullnad av ansiktet, läppar, mun och svalg vilket gör det svårt att svälja eller andas; hudutslag; nässelfeber;svullnad av händer, fötter eller anklar.
Följande biverkningar har rapporterats med SonoVue:
Mindre vanliga biverkningar (kan förekomma hos upp till 1 av 100 användare):
- Huvudvärk,
- Domningar,
- Yrsel,
- Konstig smak i munnen,
- Rodnad,
- Obehag i bröstet,
- Illamående,
- Buksmärta,
- Hudutslag,
- Värmekänsla,
- Lokal reaktion där injektionen gavs såsom: smärta eller onormal känsla vid injektionsstället,
- Förhöjt blodsocker.
Sällsynta (kan förekomma hos upp till 1 av 1000 användare):
- Dimsyn,
- Sänkt blodtryck,
- Klåda
- Ryggsmärta
- Allmän smärta,
- Bröstsmärtor,
- Trötthet,
- Allvarlig eller mindre allvarlig allergisk reaktion. Detta kan innebära hudrodnad, sänkt hjärtfrekvens och blodtryck, andnöd, medvetslöshet, hjärtstillestånd / hjärts- och andningsstillestånd eller mer allvarlig reaktion med andninssvårigheter och yrsel.
Har rapporterats (förekommer hos ett okänt antal användare):
- Bröstsmärta som strålar till nacken eller vänster arm, som kan vara ett tecken på potentiellt allvarlig allergisk reaktion som kallas Kounis syndrom,
- Blekhet,
- I vissa fall av allergiska reaktioner hos patienter med kranskärlsjukdom (hjärtsjukdom) rapporterades otillräcklig syretillförsel till hjärtat samt hjärtstillestånd.
- Kräkningar
Rapportering av biverkningar
Om du får biverkningar, tala med läkare. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om läkemedels säkerhet.
I Sverige:
Läkemedelsverket
Box 26
751 03 Uppsala
Webbplats: www.lakemedelsverket.se
I Finland:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta läkemedel utom syn‑ och räckhåll för barn.
Används före utgångsdatum som anges på etiketten. Utgångsdatumet är den sista dagen i angiven månad.
Inga särskilda förvaringsföreskrifter.
Dispersionen av SonoVue skall ges till dig inom 6 timmar efter dess beredning.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- Det aktiva innehållsämnet är svavelhexafluorid i form av mikrobubblor,
- Övriga innehållsämnen är: makrogol 4000, distearylfosfatidylkolin, natriumdipalmitylfosfatidylglycerol, palmitinsyra.
Glassprutan innehåller natriumkloridlösning 9 mg/mL (0,9%).
Läkemedlets utseende och förpackningsstorlekar:
SonoVue är ett kit innehållande en injektionsflaska av glas med vitt pulver, en injektionspruta av glas med lösningsvätska samt ett överföringssystem.
Innehavare av godkännande för försäljning och tillverkare:
Innehavare av godkännande för försäljning
Bracco International B.V.
Strawinskylaan 3051
NL ‑ 1077 ZX Amsterdam,
Holland
Tillverkare:
Bracco Imaging S.p.A
Via Ribes 5, Bioindustry Park
Colleretto Giacosa ‑ 10010 (TO)
Italien
Denna bipacksedeln ändrades senast 2021-06-24
Övriga informationskällor
Ytterligare information om detta läkemedel finns på Europeiska läkemedelsmyndighetens webbplats: http://www.ema.europa.eu .
Direktiv för experterna inom hälsovården
Om SonoVue inte används omedelbart efter beredning ska dispersionen skakas på nytt innan den dras upp i en spruta.
Läkemedlet är endast avsett för en undersökning. All oanvänd vätska som blir över efter undersökningen ska kastas.
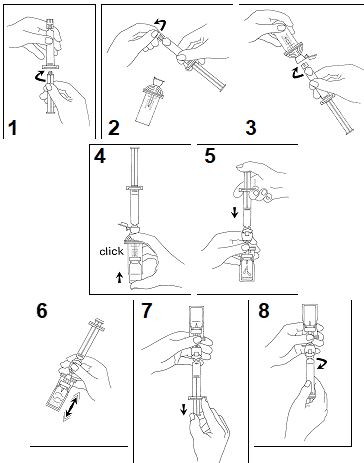
Beredningsanvisningar:
- Koppla samman kolven med sprutan genom att skruva i den medsols.
- Öppna MiniSpike-förpackningen och ta bort förslutningen på sprutan.
- Öppna överföringssystemets förslutning och koppla sprutan till överföringssystemet genom att vrida i den medsols.
- Ta bort glaslocket från injektionsflaskan. Skjut in injektionsflakan i den genomskinliga muffen på överföringssystemet och tryck fast injektionsflaskan till systemet.
- Töm sprutans innehåll i injektionsflaskan genom att trycka på kolven.
- Skaka kraftigt i 20 sekunder för att blanda allt innehåll i injektionsflaskan för att få en vit mjölkig homogen vätska.
- Vänd systemet upp och ner och dra upp SonoVue försiktigt i sprutan.
- Skruva loss sprutan från överföringssystemet.
Efter beredning är SonoVue är en homogen vit mjölkig dispersion.
Använd ej om den erhållna vätskan är genomskinlig och/eller fasta partiklar av det frystorkade pulvret kan ses i suspensionen.
SonoVue dispersion ska ges inom sex timmar efter beredning.
Läkemedel ska inte kastas i avloppet. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.