Pakkausseloste
BOOSTRIX injektionsvätska, suspension i förfylld spruta
Tilläggsinformation
Boostrix injektionsvätska, suspension i förfylld spruta
Vaccin mot difteri, stelkramp och kikhosta (acellulärt, komponent), adsorberat, med reducerat antigeninnehåll
Allmänna direktiv
Läs noga igenom denna bipacksedel innan du eller ditt barn får detta vaccin. Den innehåller information som är viktig för dig.
- Spara denna bipacksedel, du kan behöva läsa den igen.
- Om du har ytterligare frågor vänd dig till läkare eller apotekspersonal.
- Detta vaccin har ordinerats enbart åt dig eller ditt barn. Ge det inte till andra.
- Om du eller ditt barn får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även eventuella biverkningar som inte nämns i denna information. Se avsnitt Eventuella biverkningar.
I denna bipacksedel finns information om följande
1. Vad Boostrix är och vad det används för
2. Vad du behöver veta innan du eller ditt barn får Boostrix
3. Hur Boostrix ges
4. Eventuella biverkningar
5. Hur Boostrix ska förvaras
6. Förpackningens innehåll och övriga upplysningar
Vad produkten är och vad den används för
Boostrix är ett vaccin som används som påfyllnadsdos till barn från 4 års ålder, ungdomar och vuxna för att förhindra tre sjukdomar: difteri, stelkramp (tetanus) och kikhosta (pertussis). Vaccinet verkar genom att hjälpa kroppen att producera eget skydd (antikroppar) mot dessa sjukdomar.
- Difteri: Difteri påverkar huvudsakligen luftvägarna och ibland huden. Luftvägarna blir vanligtvis inflammerade (svullna) vilket kan orsaka svåra andningsproblem och i värsta fall kvävning. Bakterierna frisläpper också ett gift (toxin) som kan orsaka nervskada, hjärtproblem och i värsta fall död.
- Stelkramp (tetanus): Stelkrampsbakterier kommer in i kroppen genom skärsår, skrapsår och andra skador i huden. Skador som är särskilt utsatta för infektion är brännskador, frakturer, djupa sår och sår som förorenats med jord, damm, hästgödsel/dynga eller träflisor. Bakterierna frisläpper ett gift (toxin) som kan orsaka muskelstelhet, smärtsamma muskelspasmer, krampanfall och till och med död. Muskelspasmerna kan vara så kraftiga att de orsakar benfrakturer i ryggraden.
- Kikhosta (pertussis): Kikhosta är en mycket smittsam sjukdom som påverkar luftvägarna och orsakar svåra attacker av hosta som kan störa normal andning. Hostan åtföljs ofta av ett ”kiknande” läte, därav namnet kikhosta. Hostan varar 1-2 månader eller längre. Kikhosta hos barn kan också orsaka öroninfektioner, luftrörskatarr som kan vara under lång tid, lunginflammation, krampanfall, hjärnskador och i värsta fall dödsfall.
Inget av innehållsämnena i vaccinet kan orsaka difteri, stelkramp eller kikhosta.
Användning av Boostrix under graviditet bidrar till att skydda ditt barn mot kikhosta under de första levandsmånaderna innan han/hon grundvaccineras.
Vad du behöver veta innan produkten används
Boostrix ska inte ges:
- om du eller ditt barn tidigare fått en allergisk reaktion mot Boostrix eller något annat innehållsämne i vaccinet (anges i avsnitt Förpackningens innehåll och övriga upplysningar) eller formaldehyd. Tecken på en allergisk reaktion kan inkludera kliande hudutslag, andfåddhet och svullnad av ansikte och tunga.
- om du eller ditt barn tidigare fått en allergisk reaktion mot något vaccin mot difteri, stelkramp eller kikhosta.
- om du eller ditt barn fått en neurologisk sjukdom (encefalopati) inom 7 dagar efter tidigare vaccination med vaccin mot kikhosta.
- om du eller ditt barn har en kraftig infektion med hög feber (över 38 °C). En lättare infektion såsom en vanlig förkylning är sannolikt inget problem, men tala med läkaren först.
- om du eller ditt barn fått en tillfällig minskning av antalet blodplättar (vilket ökar risken för blödning eller blåmärken) eller en neurologisk sjukdom efter tidigare vaccination med ett vaccin mot difteri och/eller stelkramp.
Varningar och försiktighet
Tala med läkare eller apotekspersonal innan du eller ditt barn får Boostrix
- om du eller ditt barn tidigare har fått något hälsoproblem i anslutning till tidigare vaccination med Boostrix eller något annat vaccin mot kikhosta, såsom:
- hög feber (över 40 °C) inom 48 timmar efter vaccination
- kollaps eller chockliknande tillstånd inom 48 timmar efter vaccination
- ihållande, otröstlig gråt som varade 3 timmar eller längre, inom 48 timmar efter vaccination
- kramper med eller utan feber inom 3 dagar efter vaccination.
- om ditt barn har en odiagnostiserad eller pågående hjärnsjukdom eller epilepsi som inte är under kontroll. Vaccinet bör ges när sjukdomen är under kontroll.
- om du eller ditt barn har ökad risk för blödningar eller har lätt att få blåmärken
- om du eller ditt barn eller någon annan i familjen har tendens att få feberkramper
- om du eller ditt barn har långvariga problem med immunförsvaret (inklusive hiv-infektion). Du eller ditt barn erhåller eventuellt ändå Boostrix men får kanske inte ett lika bra skydd mot infektioner efter vaccinationen som vuxna och barn med fullgott immunförsvar mot infektioner.
Svimning kan förekomma (främst hos ungdomar) efter, eller även före, all nålinjektion. Tala därför om för läkaren eller sjuksköterskan om du/ditt barn har svimmat vid tidigare injektion.
Som med alla vacciner ger Boostrix eventuellt inte fullt skydd hos alla personer som vaccineras.
Andra läkemedel och Boostrix
Tala om för läkare eller apotekspersonal om du eller ditt barn tar, nyligen har tagit eller kan tänkas ta andra läkemedel eller nyligen har fått något annat vaccin.
Boostrix kan ges samtidigt med vissa andra vacciner. Ett annat injektionsställe kommer att användas för varje typ av vaccin.
Boostrix kan ha sämre effekt om du eller ditt barn tar läkemedel som minskar immunförsvarets förmåga att bekämpa infektioner.
Graviditet och amning
Om du är gravid eller ammar, tror att du kan vara gravid eller planerar att skaffa barn, rådfråga läkare eller apotekspersonal innan du får detta vaccin.
Det är inte känt om Boostrix passerar över i modersmjölk. Din läkare kommer att tala med dig om möjliga risker och fördelar av vaccination med Boostrix i samband med amning.
Körförmåga och användning av maskiner
Det är inte troligt att Boostrix skulle ha någon effekt på förmågan att framföra fordon och använda maskiner.
Du är dock själv ansvarig för att bedöma om du är i kondition att framföra motorfordon eller utföra arbete som kräver skärpt vaksamhet. En av faktorerna som kan påverka din förmåga i dessa avseenden är användningen av läkemedel på grund av deras effekter och/eller biverkningar. Beskrivning av dessa effekter och biverkningar finns i andra avsnitt. Läs därför all information i denna bipacksedel för vägledning. Diskutera med läkare eller apotekspersonal om du är osäker.
Boostrix innehåller natrium
Detta läkemedel innehåller mindre än 1 mmol (23 mg) natrium per dos, d.v.s. är näst intill “natriumfritt”.
Hur produkten används
- Boostrix ges som en injektion i muskeln.
- Vaccinet ska aldrig ges i ett blodkärl.
- Du eller ditt barn kommer att få en injektion med Boostrix.
- Din läkare kommer att kontrollera om du eller ditt barn tidigare vaccinerats mot difteri, stelkramp och/eller kikhosta.
- Boostrix kan användas vid misstänkt stelkrampssmitta, men även annan ytterligare behandling såsom noggrann sårrengöring och/eller tillförsel av stelkrampsantitoxin (motverkar stelkrampsbakteriens gift) ges för att minska risken för stelkramp.
- Din läkare kommer att ge dig råd angående ytterligare vaccinationer.
Eventuella biverkningar
Liksom alla läkemedel kan detta vaccin orsaka biverkningar men alla användare behöver inte få dem.
Som med alla vacciner för injektion kan det mycket sällan (upp till 1 av 10 000 vaccindoser) förekomma allvarliga allergiska reaktioner (anafylaktiska och anafylaktoida reaktioner). Dessa känns igen genom:
- hudutslag med blåsor eller klåda
- svullnad av ögon och ansikte
- svårighet att andas eller svälja
- plötsligt blodtrycksfall och medvetslöshet
Sådana reaktioner inträffar vanligtvis innan man hunnit lämna mottagningen. Om du eller ditt barn får några av dessa symtom ska läkare omedelbart kontaktas.
Biverkningar som förekommit under kliniska studier hos barn från 4 till 8 års ålder
Mycket vanliga (kan förekomma vid fler än 1 av 10 vaccindoser): smärta, rodnad och svullnad, vid injektionsstället, irritabilitet, sömnighet, trötthet.
Vanliga (kan förekomma vid upp till 1 av 10 vaccindoser): aptitlöshet, huvudvärk, feber 37,5 °C eller högre (inklusive högre feber än 39 °C), kraftig svullnad av den vaccinerade kroppsdelen, kräkning och diarré.
Mindre vanliga (kan förekomma vid upp till 1 av 100 vaccindoser): övre luftvägsinfektion, uppmärksamhetsstörningar, utsöndringar från ögonen med klåda och skorpor på ögonlocken (konjunktivit), hudutslag, hård knöl där injektionen gavs, smärta.
Biverkningar som förekommit under kliniska studier hos vuxna, ungdomar och barn från 10 års ålder och äldre
Mycket vanliga (kan förekomma vid fler än 1 av 10 vaccindoser): smärta, rodnad och svullnad vid injektionsstället, huvudvärk, trötthet, allmän sjukdomskänsla.
Vanliga (kan förekomma vid upp till 1 av 10 vaccindoser): feber 37,5 °C eller högre, yrsel, illamående, hård knöl och böld vid injektionsstället.
Mindre vanliga (kan förekomma vid upp till 1 av 100 vaccindoser): feber över 39 °C, smärta, led- och muskelstelhet, kräkning, diarré, ledstelhet, ledsmärta, muskelvärk, klåda, kraftig svettning (hyperhidros), hudutslag, svullna körtlar i halsen, armhålan eller ljumsken (lymfadenopati), ont i halsen eller obehag vid sväljning (faryngit), övre luftvägsinfektion, hosta, svimning (synkope), influensaliknande symtom, t.ex. feber, halsont, rinnande näsa, hosta och frossa.
Följande biverkningar förekom under rutinanvändning av Boostrix och är inte specifika för någon åldersgrupp: svullnad av ansiktet, läpparna, munnen, tungan eller halsen som kan orsaka svårighet att svälja eller andas (angioödem), kollaps eller perioder av medvetslöshet eller sänkt medvetande, kramper eller anfall (med eller utan feber), nässelfeber (urticaria), ovanlig svaghet (asteni).
Efter administrering av vacciner mot stelkramp har det mycket sällan (upp till 1 av 10 000 vaccindoser) förekommit en tillfällig inflammation i nerverna, vilken ger smärta, svaghet och förlamning av armar och ben som även kan stiga uppåt mot bröstet och ansiktet (Guillain-Barrés syndrom).
Rapportering av biverkningar
Om du eller ditt barn får biverkningar, tala med läkare eller apotekspersonal. Detta gäller även biverkningar som inte nämns i denna information. Du kan också rapportera biverkningar direkt (se detaljer nedan). Genom att rapportera biverkningar kan du bidra till att öka informationen om ett läkemedels säkerhet.:
webbplats: www.fimea.fi
Säkerhets- och utvecklingscentret för läkemedelsområdet Fimea
Biverkningsregistret
PB 55
00034 FIMEA
Hur produkten ska förvaras
Förvara detta vaccin utom syn- och räckhåll för barn.
Används före utgångsdatum som anges på kartongen och den förfyllda sprutans etikett efter Utg. dat/EXP. Utgångsdatumet är den sista dagen i angiven månad.
Förvaras i kylskåp (2 °C – 8 °C).
Får ej frysas. Frysning förstör vaccinet.
Förvaras i originalförpackningen. Ljuskänsligt.
Läkemedel ska inte kastas i avloppet eller bland hushållsavfall. Fråga apotekspersonalen hur man kastar läkemedel som inte längre används. Dessa åtgärder är till för att skydda miljön.
Förpackningens innehåll och övriga upplysningar
Innehållsdeklaration
- De aktiva substanserna är:
Difteritoxoid1 inte mindre än 2 Internationella Enheter (IE) (2,5 Lf)
Tetanustoxoid1 inte mindre än 20 Internationella Enheter (IE) (5 Lf)
Bordetella pertussis-antigen
Pertussistoxoid1 8 mikrogram
Filamentöst hemagglutinin1 8 mikrogram
Pertaktin1 2,5 mikrogram
1adsorberat på hydratiserad aluminiumhydroxid (Al(OH)3) 0,3 milligram Al3+
och aluminiumfosfat (AlPO4) 0,2 milligram Al3+
Aluminiumhydroxid och aluminiumfosfat ingår i detta vaccin som adjuvans. Adjuvans är ämnen som ingår i en del vacciner för att påskynda, förstärka och/eller förlänga vaccinets skyddseffekt.
- Övriga innehållsämnen är: natriumklorid och vatten för injektionsvätskor.
Läkemedlets utseende och förpackningsstorlekar
Injektionsvätska, suspension i förfylld spruta.
Boostrix är en vit, mjölkaktig vätska som tillhandahålls i förfylld spruta (0,5 ml).
Boostrix tillhandahålls i en förfylld spruta innehållande en dos med eller utan separata nålar i förpackningsstorlekar om 1 eller 10 stycken.
Eventuellt kommer inte alla förpackningsstorlekar att marknadsföras.
Innehavare av godkännande för försäljning och tillverkare
I Finland
Innehavare av godkännande för försäljning:
GlaxoSmithKline Biologicals s.a.
Rixensart
Belgien
Tillverkare:
GlaxoSmithKline Biologicals s.a., Rue de l’Institut 89, B-1330 Rixensart, Belgien
Representation i Finland:
GlaxoSmithKline Oy
Postbox 24
02231 ESBO
Tfn. 010 30 30 30
Detta läkemedel är godkänt inom Europeiska ekonomiska samarbetsområdet under namnet Boostrix i Belgien, Danmark, Finland, Irland, Island, Italien, Luxemburg, Norge, Portugal, Spanien, Sverige, Tyskland och Österrike.
Denna bipacksedel ändrades senast 30.5.2024
Övriga informationskällor
Information om detta läkemedel finns tillgänglig på Säkerhets- och utvecklingscentret för läkemedelsområdets hemsida: http://www.fimea.fi
Direktiv för experterna inom hälsovården
Följande uppgifter är endast avsedda för hälso- och sjukvårdspersonal:
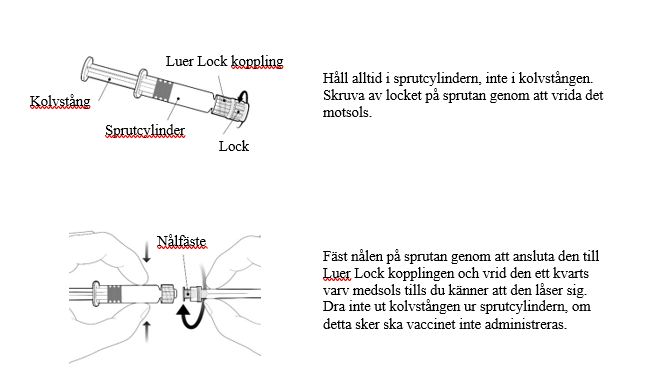
Före vaccination ska vaccinet uppnå rumstemperatur och sprutan omskakas väl till en homogen grumlig vit suspension. Före administrering ska vaccinet inspekteras visuellt med avseende på främmande partiklar och/eller fysikaliska förändringar. Administrera inte vaccinet om något avvikande observeras.
Instruktioner för den förfyllda sprutan
Destruktion:
Ej använt läkemedel och avfall ska hanteras enligt lokala anvisningar.