Pakkausseloste
BOOSTRIX injektioneste, suspensio, esitäytetty ruisku
Boostrix injektioneste, suspensio esitäytetyssä ruiskussa
Kurkkumätä, jäykkäkouristus ja hinkuyskä (soluton, komponentti) -rokote (adsorboitu, vähennetty antigeeni(en) pitoisuus)
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin saat tai lapsesi saa tätä rokotetta, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle tai lapsellesi eikä sitä pidä antaa muiden käyttöön.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Boostrix on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin saat/lapsesi saa Boostrixia
3. Miten Boostrix annetaan
4. Mahdolliset haittavaikutukset
5. Boostrixin säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Boostrix on yhdistelmärokote kurkkumätää (difteria), jäykkäkouristusta (tetanus) ja hinkuyskää (pertussis) vastaan, ja se on tarkoitettu tehosterokotukseen aikuisille, nuorille ja lapsille 4 vuoden iästä alkaen. Rokote vaikuttaa saamalla elimistössä aikaan omien vasta-aineiden (suojan) muodostuksen näitä tauteja vastaan.
- Kurkkumätä (difteria): Kurkkumätä vaikuttaa yleensä hengitysteihin ja joskus ihoon. Yleensä hengitystiet tulehtuvat (turpoavat), mikä voi aiheuttaa pahoja hengitysvaikeuksia ja joskus tukehtumisen. Bakteereista vapautuu myös myrkkyä, joka voi aiheuttaa hermovauriota, sydänongelmia ja jopa kuoleman.
- Jäykkäkouristus (tetanus): Tetanusbakteeri pääsee elimistöön ihon haavojen, naarmujen tai muiden vaurioiden kautta. Erityisen infektioalttiita vaurioita ovat palovammat, murtumat, syvät haavat ja haavat, joissa on multaa, pölyä, hevosen lantaa tai puutikkuja. Bakteereista vapautuu toksiinia (myrkkyä), joka voi aiheuttaa lihasjäykkyyttä, kivuliaita lihasspasmeja, kouristuksia ja jopa kuoleman. Lihaskouristus voi olla niin voimakas, että se aiheuttaa selkärangan luiden murtumia.
- Hinkuyskä (pertussis): Hinkuyskä on erittäin tarttuva tauti. Tauti iskee hengitysteihin ja aiheuttaa voimakkaita yskänpuuskia, jotka voivat häiritä normaalia hengittämistä. Yskään liittyy usein "hinkuva" ääni, josta tauti on saanut nimensä. Yskä voi kestää 1 ‑ 2 kuukautta tai vieläkin pitempään. Hinkuyskään voi liittyä myös korvatulehdus, pitkään kestävä keuhkoputkentulehdus, keuhkokuume, kouristuksia, aivovaurio tai jopa kuolema.
Mikään rokotteen aineosa ei voi aiheuttaa kurkkumätää, jäykkäkouristusta eikä hinkuyskää.
Raskausaikana annettu Boostrix-rokotus auttaa suojaamaan vauvaa hinkuyskältä ensimmäisinä elinkuukausina ennen perusrokotusten antamista.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Boostrixia ei saa antaa
- jos olet ollut tai lapsesi on ollut yliherkkä (allerginen) Boostrixille tai jollekin rokotteen muulle aineosalle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa) tai formaldehydille. Allergisen reaktion merkkejä voivat olla kutiava ihottuma, hengenahdistus sekä kasvojen ja kielen turvotus.
- jos sinulla tai lapsellasi on ollut allerginen reaktio aiemman kurkkumätä-, jäykkäkouristus- tai hinkuyskärokotuksen saamisen jälkeen
- jos sinulla tai lapsellasi oli hermostollisen sairauden aiheuttamia oireita (enkefalopatiaa) 7 päivän kuluessa jonkin aiemman hinkuyskärokotuksen jälkeen
- jos sinulla tai lapsellasi on vaikea tulehdussairaus ja korkea kuume (yli 38 °C). Lievä sairaus, kuten nuhakuume, ei yleensä ole ongelma, mutta neuvottele asiasta ensin lääkärin kanssa.
- jos sinulla tai lapsellasi on ollut ohimenevää verihiutaleiden niukkuutta (mikä lisää verenvuotoriskiä tai mustelmataipumusta) tai aivo- tai hermokomplikaatioita aiemman kurkkumätä- ja/tai jäykkäkouristusrokotuksen jälkeen
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin saat/lapsesi saa Boostrixia.
- jos sinulla tai lapsellasi on ollut oireita aikaisemmin Boostrixin tai muun hinkuyskärokotuksen yhteydessä, erityisesti:
- ≥ 40,0 °C:n kuume 2 vuorokauden kuluessa rokotuksesta
- tajunnanmenetys tai sokinkaltainen tila 2 vuorokauden kuluessa rokotuksesta
- tyyntymätöntä itkua yli 3 tunnin ajan 2 vuorokauden kuluessa rokotuksesta
- kouristuksia ja mahdollisesti korkeaa kuumetta 3 vuorokauden kuluessa rokotuksesta
- lapsella on diagnosoimaton tai progressiivinen aivosairaus tai kontrolloimaton epilepsia. Rokote tulee antaa, kun tauti on saatu hallintaan.
- jos saat tai jos lapsesi saa helposti verenvuotoja tai mustelmia
- jos sinulla tai lapsellasi on taipumusta kuumekouristuksiin tai kouristuksia esiintyy suvussa
- jos sinulla tai lapsellasi on mistä tahansa syystä johtuva, pitkäaikainen immuunijärjestelmän ongelma (HIV infektio mukaan lukien). Boostrixia voidaan näissä tilanteissa antaa, mutta rokotteen antama suoja infektioita vastaan saattaa olla heikompi kuin hyvän immuniteetin omaavilla aikuisilla tai lapsilla.
Pyörtymistä voi esiintyä (enimmäkseen nuorilla) pistoksena annettavan rokotuksen jälkeen, tai jopa ennen. Kerro lääkärille tai hoitajalle, jos olet/lapsesi on pyörtynyt aikaisemman pistoksena annettavan rokotuksen yhteydessä.
Kuten kaikki rokotteet Boostrix ei ehkä täysin suojaa kaikkia rokotettuja tartunnalta.
Muut lääkevalmisteet ja Boostrix
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan saat/lapsesi saa, tai on saanut, tai saattaa joutua saamaan muita lääkkeitä, tai jos olet/lapsesi on saanut jonkin muun rokotuksen.
Boostrixia voidaan antaa samanaikaisesti joidenkin muiden rokotteiden kanssa. Jokaiselle rokotetyypille käytetään eri pistoskohtaa.
Boostrixin teho saattaa olla huonompi, jos samanaikaisesti käyttää lääkkeitä, jotka alentavat immuunijärjestelmän kykyä torjua infektioita.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen kuin saat tätä rokotetta.
Boostrixin erittymisestä äidinmaitoon ei ole tietoa. Lääkäri kertoo sinulle mahdollisista eduista ja riskeistä, joita Boostrixin antamiseen imetyskauden aikana liittyy.
Ajaminen ja koneiden käyttö
Boostrix ei todennäköisesti vaikuta autolla-ajokykyyn eikä koneidenkäyttökykyyn.
Boostrix sisältää natriumia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Miten valmistetta käytetään
- Boostrix annetaan pistoksena lihakseen.
- Rokotetta ei saa missään tapauksessa antaa suoneen.
- Sinulle tai lapsellesi annetaan yksi Boostrix-injektio.
- Lääkäri varmistaa, oletko saanut/onko lapsesi saanut aikaisempia kurkkumätä-, jäykkäkouristus- ja/tai hinkuyskärokotuksia.
- Boostrixia voidaan käyttää tilanteissa, joissa epäillään jäykkäkouristusinfektiota. Muut varotoimet ovat kuitenkin myös tarpeen, esim. haavan sidetaitokset ja/tai tetanus-vasta-aineiden anto. Näin minimoidaan taudin ilmaantumisen riski.
- Lääkäri kertoo uusintarokotusten tarpeesta.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin rokote voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Kuten kaikkien injisoitavien rokotteiden kohdalla vakavia allergisia reaktioita (anafylaktisia ja anafylaktoidisia reaktioita) saattaa esiintyä hyvin harvoin (harvemmin kuin kerran 10000 rokoteannoksen jälkeen). Vakavan allergisen reaktion oireita ovat
- Ihottumat, jotka voivat olla kutisevia tai rakkulamaisia
- Silmien tai kasvojen turpoaminen
- Hengitys- tai nielemisvaikeudet
- Verenpaineen äkillinen lasku ja tajunnan menetys
Näitä oireita voi esiintyä jo lääkärin vastaanotolla. Ota joka tapauksessa heti yhteyttä lääkäriin, jos sinulle tai lapsellesi ilmaantuu näitä oireita.
Haittavaikutuksia, joita on esiintynyt kliinisissä lääketutkimuksissa 4−8-vuotiailla lapsilla.
Hyvin yleiset (voivat esiintyä useammin kuin kerran 10 rokoteannosta kohti): pistoskohdan kipu, punoitus ja turvotus, ärtyneisyys, uneliaisuus, väsymys.
Yleiset (voivat esiintyä enintään kerran 10 rokoteannosta kohti): ruokahaluttomuus, päänsärky, kuume 37,5 °C tai enemmän (mukaan lukien yli 39,0 °C kuume), pistetyn raajan laajalle levinnyt turpoaminen, oksentelu ja ripuli.
Melko harvinaiset (voivat esiintyä enintään kerran 100 rokoteannosta kohti): ylähengitystieinfektiot, huomiokykyyn liittyvä häiriö, silmien vetisyys ja kutina ja silmäluomioireet (konjuktiviitti), ihottuma, injektiokohdan kovettuma, kipu.
Haittavaikutuksia, joita on esiintynyt kliinisissä tutkimuksissa aikuisilla, nuorilla ja lapsilla 10 vuoden iästä lähtien
Hyvin yleiset (voivat esiintyä useammin kuin kerran 10 rokoteannosta kohti): pistoskohdan kipu, punoitus ja turvotus, päänsärky, väsymys, huonovointisuus.
Yleiset (voivat esiintyä enintään kerran 10 rokoteannosta kohti): kuume 37,5 °C tai enemmän, huimaus, pahoinvointi, injektiokohdan kovettuma ja märkäpesäke.
Melko harvinaiset (voivat esiintyä enintään kerran 100 rokoteannosta kohti): kuume, yli 39 °C, kipu, nivel- ja lihasjäykkyys, oksentelu, ripuli, niveljäykkyys, nivelkipu, lihaskipu, kutina, voimakas hikoilu (hyperhidroosi), ihottuma, rauhasten turpoaminen niskassa, kainalokuopassa tai nivuksissa (lymfadenopatia), kurkkukipu ja nielemisvaikeudet (faryngiitti), ylähengitystieinfektiot, yskä, pyörtyminen, flunssankaltaiset oireet kuten kuume, kurkkukipu, vuotava nenä, yskä ja vilunväristykset.
Seuraavat haittavaikutukset ovat esiintyneet Boostrixin rutiinikäytössä. Ne eivät liity tiettyyn ikäryhmään: kasvojen, huulten, suun, kielen tai kurkun turpoaminen, mikä voi johtaa nielemis- tai hengitysvaikeuksiin (angioedeema), kollapsi tai ajoittainen tajunnan menetys, huomiokykyyn liittyvä häiriö, kouristuskohtaukset (joihin voi liittyä kuumetta), nokkosihottuma (urtikaria), epätavallinen heikkous (astenia).
Jäykkäkouristusrokotuksen jälkeen on raportoitu hyvin harvoin (harvemmin kuin kerran 10 000 rokoteannoksen jälkeen) tilapäistä hermotulehdusta, johon on liittynyt raajojen kipua, heikkoutta ja paralyysiä. Oireet ovat usein levinneet rintaan ja kasvoihin (Guillain-Barrén oireyhtymä).
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä rokotetta ulkopakkaukseen ja nimilippuun merkityn viimeisen käyttöpäivämäärän jälkeen (EXP). Viimeinen käyttöpäivä on merkityn kuukauden viimeinen päivä.
Säilytä jääkaapissa (2 °C - 8 °C).
Ei saa jäätyä. Jäätyminen tuhoaa rokotteen.
Säilytä alkuperäispakkauksessa. Herkkä valolle.
Lääkkeitä ei pidä heittää viemäriin, eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Boostrix sisältää
- Vaikuttavat aineet ovat:
Difteriatoksoidi1 vähintään 2 kansainvälistä yksikköä (IU) (2,5 Lf)
Tetanustoksoidi1 vähintään 20 kansainvälistä yksikköä (IU) (5 Lf)
Bordetella pertussis antigeenit:
Pertussistoksoidi1 8 mikrogrammaa
Filamenttihemagglutiniini1 8 mikrogrammaa
Pertaktiini1 2,5 mikrogrammaa
1adsorboituna alumiinihydroksidiin (hydratoituun) (Al(OH)3) 0,3 milligrammaa Al3+
ja alumiinifosfaattiin (AlPO4) 0,2 milligrammaa Al3+
Alumiinihydroksidi ja alumiinifosfaatti ovat adjuvantteja. Tietyt rokotteet sisältävät adjuvantteja, sillä niiden avulla rokotteen aikaansaama suojavaikutus saadaan nopeammaksi, paremmaksi ja/tai pidemmäksi.
- Apuaineet ovat: natriumkloridi ja injektionesteisiin käytettävä vesi.
Rokotteen kuvaus ja pakkauskoko
Injektioneste, suspensio esitäytetyssä ruiskussa
Boostrix on valkoinen, hieman maitomainen neste esitäytetyssä ruiskussa (0,5 ml).
Boostrix on saatavana 1 esitäytetyn ruiskun pakkauksessa erillisellä neulalla tai ilman neulaa, pakkauskoot 1 ja 10.
Kaikkia pakkauskokoja ei välttämättä ole markkinoilla.
Myyntiluvan haltija ja valmistaja:
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89
1330 Rixensart
Belgia
Edustaja Suomessa:
GlaxoSmithKline Oy
PL 24
02231 ESPOO
Puh. 010 30 30 30
Tämä lääkevalmiste on hyväksytty Euroopan talousalueella (ETA) nimellä Boostrix Belgiassa, Tanskassa, Ruotsissa, Irlannissa, Islannissa, Italiassa, Luxemburgissa, Norjassa, Portugalissa, Espanjassa, Suomessa, Saksassa ja Itävallassa.
Tämä seloste on tarkistettu viimeksi 30.5.2024
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Lääkealan turvallisuus- ja kehittämiskeskuksen verkkosivuilta http://www.fimea.fi
Ohjeet terveydenhuollon ammattilaiselle
Seuraavat tiedot on tarkoitettu vain terveydenhoitoalan henkilökunnalle:
Ennen käyttöä rokotteen on annettava lämmetä huoneenlämpöiseksi ja rokotetta ravistetaan hyvin, jotta saadaan tasainen samea valkoinen suspensio. Ennen rokottamista rokote tarkastetaan silmämääräisesti vierashiukkasten ja/tai fysikaalisten muutosten varalta. Jos muutoksia havaitaan, rokotetta ei saa antaa.
Esitäytetyn ruiskun käyttöohje
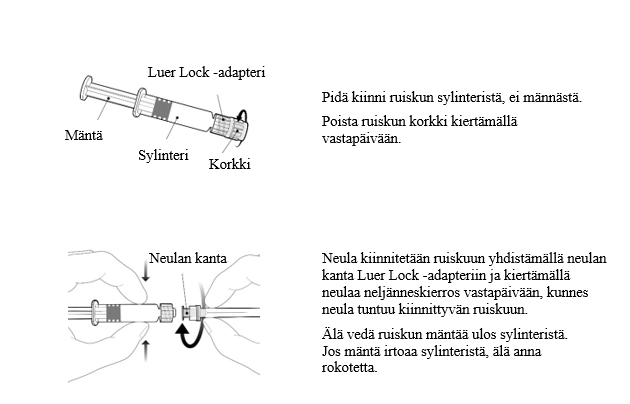
Hävitys:
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaisesti.