Pakkausseloste
PHENOLEPTIL VET tabletti 25 mg, 100 mg
ELÄINLÄÄKEVALMISTEEN NIMI
Phenoleptil vet 25 mg ja 100 mg tabletit koiralle
fenobarbitaali
VAIKUTTAVAT JA MUUT AINEET
Kuvaus
Phenoleptil vet 25 mg: Valkoinen tai luonnonvalkoinen, pyöreä, kupera tabletti, jossa on ruskeita täpliä ja toisella puolella ristikkäisjakouurre (halkaisija 8 mm). Tabletti voidaan jakaa kahteen tai neljään yhtä suureen osaan.
Phenoleptil vet 100 mg: Valkoinen tai luonnonvalkoinen, pyöreä, kupera tabletti, jossa on ruskeita täpliä ja toisella puolella ristikkäisjakouurre (halkaisija 13 mm). Tabletti voidaan jakaa kahteen tai neljään yhtä suureen osaan.
Vaikuttavan aineen määrä yhdessä tabletissa
Fenobarbitaali 25 mg
Fenobarbitaali 100 mg
KÄYTTÖAIHEET
Yleistyneen epilepsian aiheuttamien kohtausten ehkäisy koirilla.
VASTA-AIHEET
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle tai muille barbituraateille.
Ei saa käyttää eläimille, joiden maksan toiminta on vakavasti huonontunut.
Ei saa käyttää eläimille, joilla on vakava munuais- tai sydän-verisuonisairaus.
Phenoleptil vet 25 mg: ei saa käyttää alle 2,5 kg:n painoisille koirille.
Phenoleptil vet 100 mg: ei saa käyttää alle 10 kg:n painoisille koirille.
HAITTAVAIKUTUKSET
Hoidon aloituksen yhteydessä voi hyvin harvoin ilmetä liikkeiden haparointia, uneliaisuutta, letargiaa (horroksen kaltainen tila) ja huimausta, mutta nämä vaikutukset ovat yleensä ohimeneviä ja häviävät useimmiten, mutta ei aina, kun hoitoa jatketaan.
Joillakin eläimillä voi hyvin harvoin esiintyä paradoksaalista ylikiihtyvyyttä erityisesti hoitoa aloitettaessa.
Koska tämä ylikiihtyvyys ei liity yliannostukseen, ei annoksen pienentäminen ole tarpeen.
Lisääntynyttä virtsaamista, lisääntynyttä juomista ja ahmimista voi hyvin harvoin esiintyä keskimääräisillä tai sitä suuremmilla terapeuttisilla aktiivisilla pitoisuuksilla seerumissa. Näitä vaikutuksia voidaan vähentää rajoittamalla ruoan ja veden saantia.
Rauhoittuminen ja liikkeiden haparointi ovat usein merkittävä huolenaihe (ilmenevät hyvin harvoin), kun pitoisuudet seerumissa kohoavat hoitoalueen ylärajalle.
Suureen pitoisuuteen plasmassa voi liittyä maksatoksisuutta (hyvin harvinainen).
Fenobarbitaalilla voi olla haitallinen vaikutus luuytimen kantasoluihin, minkä seurauksena voi ilmetä immunotoksista verisolujen vähyyttä ja/tai veren neutrofiilien vähyyttä (hyvin harvinainen). Nämä reaktiot häviävät, kun hoito lopetetaan.
Kun koiria hoidetaan fenobarbitaalilla, niiden seerumin tyroksiinin (T4) ja vapaan tyroksiinin (T4-V) pitoisuudet saattavat pienentyä, mikä ei kuitenkaan välttämättä ole merkki kilpirauhasen vajaatoiminnasta. Kilpirauhashormonikorvaushoitoa ei pidä aloittaa, ellei havaita kliinisiä merkkejä sairaudesta.
Annetun annoksen pienentämistä on suositeltava, jos haittavaikutukset ovat vakavia.
Haittavaikutusten esiintyvyys määritellään seuraavasti:
- hyvin yleinen (useampi kuin 1/10 hoidettua eläintä saa haittavaikutuksen yhden hoitokerran aikana)
- yleinen (useampi kuin 1 mutta alle 10/100 hoidettua eläintä)
- melko harvinainen (useampi kuin 1 mutta alle 10/1000 hoidettua eläintä)
- harvinainen (useampi kuin 1 mutta alle 10/10 000 hoidettua eläintä)
- hyvin harvinainen (alle 1/10 000 hoidettua eläintä, mukaan lukien yksittäiset ilmoitukset).
Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita asiasta eläinlääkärillesi.
Vaihtoehtoisesti voit myös ilmoittaa kansallista raportointijärjestelmää käyttäen {www.fimea.fi/elainlaakkeet/}
KOHDE-ELÄINLAJI
Koira.
ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Antotapa
Suun kautta.
Annosten suuruus
Suositeltu aloitusannos on 2,5 mg fenobarbitaalia painokiloa kohti kahdesti vuorokaudessa.
Tabletit on annettava samaan aikaan joka päivä, jotta hoito onnistuu.
Jos annosta muutetaan, muutos pitää tehdä kliinisen tehon, veriarvojen ja haittavaikutusten ilmenemisen perusteella. Tarvittava annostus vaihtelee jonkin verran yksilöstä riippuen sekä sairauden luonteen ja vaikeusasteen mukaan.
ANNOSTUSOHJEET
Phenoleptil vet 25 mg: Tabletin toisella puolella oleva ristijakouurre mahdollistaa tabletin jakamisen kahteen (12,5 mg fenobarbitaalia sisältävään) tai neljään (6,25 mg fenobarbitaalia sisältävään) yhtä suureen osaan.
Phenoleptil vet 100 mg: Tabletin toisella puolella oleva ristijakouurre mahdollistaa tabletin jakamisen kahteen (50 mg fenobarbitaalia sisältävään) tai neljään (25 mg fenobarbitaalia sisältävään) yhtä suureen osaan.
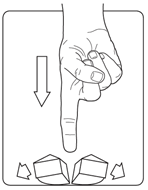
- Aseta tabletti tasaiselle pinnalle pyöreä puoli alaspäin
- Jaa tabletti neljään yhtä suureen osaan painamalla tabletin päältä peukalolla tai etusormella
Fenobarbitaalin pitoisuus seerumissa pitää mitata, kun vakaa tila on saavutettu. Verikokeet voidaan ottaa samanaikaisesti, sillä fenobarbitaalin pitoisuus plasmassa pitäisi mieluiten määrittää pitoisuuden ollessa alimmillaan eli hieman ennen kuin seuraava annos on määrä antaa. Seerumin fenobarbitaalin pitoisuuden ihanteellinen terapeuttinen alue on 15–40 mikrog/ml. Jos fenobarbitaalin pitoisuus on alle 15 mikrog/ml tai kohtauksia edelleen esiintyy, annosta voidaan nostaa 20 % kerrallaan ja samalla fenobarbitaalin pitoisuutta seerumissa on seurattava, kunnes pitoisuus on korkeintaan 45 mikrog/ml. Suurimmat annokset voivat vaihdella huomattavasti (vaihtelualue 1–15 mg painokiloa kohti kahdesti vuorokaudessa), mikä johtuu eroista fenobarbitaalin erittymisessä ja potilaiden erilaisesta herkkyydestä.
Jos kohtauksia ei saada tyydyttävään hoitotasapainoon ja jos suurin pitoisuustaso on noin 40 mikrog/ml, on diagnoosia pohdittava uudelleen ja/tai hoito-ohjelmaan on lisättävä toinen epilepsialääke (kuten bromidi).
Jos potilaan epilepsia on tasapainossa, siirtymistä muista fenobarbitaalin lääkemuodoista Phenoleptil vet tabletteihin ei suositella. Jos sitä ei kuitenkaan voida välttää, hoidossa on noudatettava entistä suurempaa varovaisuutta. Aiemmin käytettyyn lääkemuotoon verrattuna mahdollisimman samanlaiseen annostukseen pyrkimistä suositellaan ottaen huomioon senhetkiset plasman pitoisuuden mittaustulokset. Tällöin pitää noudattaa samankaltaista vakauttamista kuin hoitoa aloitettaessa. Katso myös kohta ERITYISVAROITUKSET).
VAROAIKA
Ei oleellinen.
SÄILYTYSOLOSUHTEET
Älä säilytä yli 30 °C.
Ei lasten näkyville eikä ulottuville.
Säilytä läpipainopakkaus ulkopakkauksessa. Herkkä valolle.
Älä käytä tätä eläinlääkevalmistetta viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu läpipainopakkauksessa ja pahvikotelossa.
Säilytä jaetut tabletit läpipainopakkauksessa. Hävitä käyttämättömät jaetut tabletit 48 tunnin kuluttua.
ERITYISVAROITUKSET
Erityisvaroitukset kohde-eläinlajeittain
Päätös epilepsialääkityksen aloittamisesta fenobarbitaalilla on arvioitava yksilöllisesti ja perustuu koiralla esiintyvien kohtausten lukumäärään, esiintymistiheyteen, kestoon ja vaikeusasteeseen.
Lääkehoidon aloittamista voidaan yleensä suositella, kun koiralla on yksittäinen kohtaus, joka ilmenee useammin kuin kerran 4–6 viikon välein, sarjoittaista kohtauksellista toimintaa (eli useampi kuin yksi kohtaus vuorokaudessa) tai epileptinen sarjakohtaus esiintymistiheydestä riippumatta.
Joillakin koirilla ei esiinny epileptisiä kohtauksia hoidon aikana lainkaan, mutta joillakin koirilla tapahtuu vain kohtausten määrän vähenemistä, ja joillakin koirilla ei saada hoitovastetta.
Eläimiä koskevat erityiset varotoimet
Pienempien koirien annoksia ei voi säätää suositellun 20 % ohjeen mukaisesti, ja sen vuoksi näitä eläimiä on seurattava erityisen huolellisesti. Ks. myös kohta ANNOSTUSOHJEET.
Fenobarbitaalihoidon päättäminen ja siirtyminen toiseen epilepsialääkkeeseen / toisesta epilepsialääkkeestä on tehtävä vähitellen, jotta vältetään kohtausten esiintymistiheyden nopea lisääntyminen.
Varovaisuutta on noudatettava eläimillä, joilla munuaisten toiminta on huonontunut, joilla on pienentynyt veren tilavuus, anemiaa tai sydämen tai hengitystoiminnan häiriö.
Maksa-arvot on tarkistettava ennen hoidon aloittamista.
Maksatoksisten haittavaikutusten todennäköisyyttä voidaan pienentää tai viivästyttää käyttämällä mahdollisimman pientä vaikuttavaa annosta. Pitkäaikaisen hoidon yhteydessä suositellaan maksa-arvojen seurantaa.
Potilaan kliinisen tilan arviointia esim. maksaentsyymien ja seerumin sappihappojen mittauksilla suositellaan 2–3 viikon kuluttua hoidon aloittamisesta ja sen jälkeen 4–6 kuukauden välein. On tärkeää tietää, että hapenpuute voi aiheuttaa maksaentsyymiarvojen suurentumista kohtauksen jälkeen. Fenobarbitaali saattaa aiheuttaa seerumin alkaalisten fosfataasien ja transaminaasien kohoamista. Nämä voivat johtua ei-patologisista muutoksista, mutta voivat myös olla merkki maksatoksisuudesta, minkä vuoksi suositellaan maksan toimintakokeita. Fenobarbitaalin annosta ei tarvitse aina välttämättä pienentää kohonneiden maksaentsyymiarvojen vuoksi, jos seerumin sappihappoarvot ovat normaalit.
Kouristuksia ehkäisevien lääkkeiden samanaikaiseen antoon liittvvää maksatoksisuutta kuvaavien yksittäisten raporttien perusteella suositellaan seuraavaa:
- Maksan toiminta arvioidaan ennen hoidon aloittamista (esim. seerumin sappihappojen mittaus).
- Fenobarbitaalin terapeuttisia pitoisuuksia seerumissa seurataan, jotta voidaan käyttää mahdollisimman pientä vaikuttavaa annosta. Tyypillisesti epilepsian hallinnassa vaikuttavia ovat 15-45 mikrog/ml:n pitoisuudet.
- Maksan toiminta arvioidaan uudelleen säännöllisesti (6‑12 kuukauden välein).
- Kohtauksellista toimintaa arvioidaan uudelleen säännöllisesti.
Erityiset varotoimenpiteet, joita eläinlääkevalmistetta antavan henkilön on noudatettava:
- Barbituraatit voivat aiheuttaa yliherkkyyttä. Henkilöiden, jotka ovat yliherkkiä barbituraateille, tulee välttää kosketusta eläinlääkevalmisteen kanssa.
- Valmisteen nieleminen vahingossa voi aiheuttaa myrkytyksen ja johtaa kuolemaan, varsinkin lapsilla. Huolehdi äärimmäisen hyvin siitä, etteivät lapset joudu kosketukseen eläinlääkevalmisteen kanssa.
- Fenobarbitaali on epämuodostumia aiheuttavaa (teratogeenista) ja voi olla myrkyllistä syntymättömille lapsille ja imeväisille; se voi vaikuttaa aivojen kehitykseen ja saada aikaan kognitiivisia häiriöitä. Fenobarbitaali erittyy rintamaitoon. Raskaana olevien sekä naisten, jotka voivat saada lapsia ja imettävien äitien on vältettävä valmisteen nielemistä vahingossa sekä pitkittynyttä ihokosketusta valmisteen kanssa.
- Säilytä tätä valmistetta sen alkuperäisessä pakkauksessa, jotta vältytään sen nielemiseltä vahingossa.
- Ihokontaktin vähentämiseksi valmistetta annettaessa on suositeltavaa käyttää kertakäyttökäsineitä.
- Jos vahingossa nielet valmistetta, käänny välittömästi lääkärin puoleen kertoen, että kyseessä on barbituraattimyrkytys, ja näytä hänelle pakkausseloste tai myyntipäällys. Mikäli mahdollista, lääkärille on kerrottava milloin ja miten paljon eläinlääkevalmistetta on nautittu. Tämä tieto voi auttaa varmistamaan asianmukaisen hoidon saamisen.
- Joka kerta kun käyttämätön tabletin osa aiotaan säilyttää seuraavaa käyttökertaa varten, se pitää laittaa takaisin läpipainopakkauksen avattuun syvennykseen ja läpipainopakkaus on laitettava takaisin pahvirasiaan.
- Pese kädet huolellisesti käytön jälkeen.
Tiineys:
Voidaan käyttää ainoastaan hoitavan eläinlääkärin tekemän hyöty-haitta-arvion perusteella.
Laboratorioeläimillä tehdyissä tutkimuksissa on osoitettu, että fenobarbitaalilla on vaikutusta sikiökautiseen kasvuun; erityisesti se aiheuttaa pysyviä muutoksia neurologisessa ja sukupuolisessa kehityksessä. Tiineydenaikaiseen fenobarbitaalin käyttöön on liittynyt vastasyntyneen verenvuototaipumusta.
Emon epilepsia voi olla sikiön heikentyneen kehityksen lisäriskitekijä. Siksi epilepsiaa sairastavien koirien tiineeksi tulemista on mahdollisuuksien mukaan vältettävä. Tiineillä koirilla on punnittava huolellisesti, käytetäänkö lääkitystä tiineyden aikana vai lykätäänkö hoitoa, koska on olemassa riski, että lääkitys voi aiheuttaa synnynnäisten vikojen määrän lisääntymistä. Hoidon lopettamista ei suositella, mutta annostus olisi pidettävä mahdollisimman pienenä.
Fenobarbitaali läpäisee istukan eikä vastasyntyneiden (korjautuvia) vieroitusoireita voida sulkea pois suuria annoksia käytettäessä.
Eläinlääkevalmisteen turvallisuutta koirilla tiineyden aikana ei ole osoitettu.
Imetys:
Voidaan käyttää ainoastaan hoitavan eläinlääkärin tekemän hyöty-haitta-arvion perusteella.
Fenobarbitaalia erittyy pieniä määriä maitoon ja pentuja on seurattava huolellisesti imetyksen aikana mahdollisten rauhoittavien haittavaikutusten varalta. Varhainen vieroitus voi olla vaihtoehto. Jos imevillä vastasyntyneillä ilmenee uneliaisuutta/rauhoittumista (jotka voivat haitata imemistä), on valittava keinotekoinen imetysmenetelmä.
Eläinlääkevalmisteen turvallisuutta koirilla imetyksen aikana ei ole osoitettu.
Yliannostus (oireet, hätätoimenpiteet, vastalääkkeet) (tarvittaessa):
Yliannostuksen oireita ovat:
- keskushermoston lamaantuminen, jonka oireet vaihtelevat unesta koomaan
- hengitysvaikeudet
- sydän-verisuonivaivat, verenpaineen lasku ja munuaistoiminnan romahtamiseen ja kuolemaan johtava sokki.
Yliannostustapauksessa poista nielty valmiste mahasta ja anna tarvittaessa hengityksen sekä sydämen ja verisuoniston tukihoitoa.
Hoidon ensisijaisia tavoitteita ovat tällöin oireenmukainen hoito sekä tukihoito, jossa erityistä huomiota kiinnitetään sydämen ja verisuoniston, hengityselinten ja munuaisten toimintaan sekä elektrolyyttitasapainon ylläpitoon.
Erityistä vastalääkettä ei ole, mutta keskushermostoa stimuloivat valmisteet (kuten doksapraami) voivat stimuloida hengityskeskusta.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Epilepsian hoitoon käytettävän fenobarbitaalin hoitoannos voi merkittävästi indusoida plasman proteiineja (kuten alfa-1-glykoproteiinia, AGP), jotka sitovat lääkkeitä. Sen vuoksi huomiota on erityisesti kiinnitettävä samanaikaisesti annettavien lääkkeiden farmakokinetiikkaan ja annoksiin.
Syklosporiinin, kilpirauhashormonien ja teofylliinin plasmapitoisuudet pienenevät, kun fenobarbitaalia annetaan niiden kanssa samanaikaisesti. Myös näiden lääkeaineiden teho heikkenee.
Simetidiini ja ketokonatsoli ovat maksaentsyymien estäjiä: samanaikainen käyttö fenobarbitaalin kanssa voi aiheuttaa fenobarbitaalin pitoisuuden suurenemista plasmassa.
Samanaikainen käyttö kaliumbromidin kanssa lisää haimatulehduksen riskiä.
Samanaikainen käyttö muiden keskushermostoa lamauttavien lääkkeiden, kuten huumaavien kipulääkkeiden, morfiinijohdannaisten, fentiatsiinien, antihistamiinien, klomipramiinin ja kloramfenikolin, kanssa voi voimistaa fenobarbitaalin vaikutusta.
Fenobarbitaali saattaa tehostaa epilepsialääkkeiden, kloramfenikolin, kortikosteroidien, doksisykliinin, beetasalpaajien ja metronidatsolin metaboliaa ja sitä kautta heikentää niiden vaikutusta.
Suun kautta otettavien raskaudenehkäisyvalmisteiden luotettavuus on alentunut.
Fenobarbitaali voi pienentää griseofulviinin imeytymistä.
Seuraavat lääkkeet saattavat pienentää kohtauskynnystä: esimerkiksi kinolonit, suuret beetalaktaamiantibioottiannokset, teofylliini, aminofylliini, syklosporiini ja propofoli. Kohtauskynnystä mahdollisesti muuttavia lääkkeitä saa käyttää vain silloin, kun niiden käyttö on todella välttämätöntä eikä turvallisempia vaihtoehtoja ole.
Fenobarbitaalitablettien käyttöä yhdessä primidonin kanssa ei suositella, koska primidoni metaboloituu pääasiassa fenobarbitaaliksi.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä eläinlääkäriltäsi tai apteekista. Nämä toimenpiteet on tarkoitettu ympäristön suojelemiseksi.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
Phenoleptil vet 25 mg: 20.02.2023
Phenoleptil vet 100 mg: 28.04.2023
MUUT TIEDOT
Farmakodynamiikka
Fenobarbitaalin epilepsian oireita vähentävä vaikutus johtuu luultavasti vähintään kahdesta mekanismista: monosynaptisen transmission heikkeneminen, joka oletettavasti johtaa vähentyneeseen hermoärtyvyyteen, ja liikekuoren sähköstimulaatiokynnyksen suurentuminen.
Farmakokinetiikka
Koiralle suun kautta annettu fenobarbitaali imeytyy nopeasti ja suurimmat fenobarbitaalipitoisuudet plasmassa havaitaan noin 4–8 tunnin kuluttua. Biologinen hyötysuhde on 86–96 %, ilmeinen jakaantumistilavuus on 0,75 l/kg ja vakaan tilan pitoisuus seerumissa saavutetaan 2–3 viikon kuluttua hoidon aloittamisesta.
Noin 45 % plasman fenobarbitaalista on sitoutunut proteiineihin. Fenobarbitaali metaboloituu maksassa para-asemassa olevan fenyyliryhmän (p-hydroksifenobarbitaali) aromaattisen hydroksylaation kautta ja noin 25 % lääkkeestä erittyy muuttumattomana virtsaan. Eliminaation puoliintumisaika vaihtelee huomattavasti eri yksilöiden välillä ja on noin 40–90 tuntia.
Pakkauskoot:
100 tablettia pahvikotelossa, jossa on 10 alumiini/PVC-läpipainopakkausta. Yksi läpipainopakkaus sisältää 10 tablettia.
100 tablettia pahvikotelossa, jossa on 10 alumiini/PVC/PE/PVdC-läpipainopakkausta. Yksi läpipainopakkaus sisältää 10 tablettia.
500 tablettia pahvikotelossa, jossa on 50 alumiini/PVC-läpipainopakkausta. Yksi läpipainopakkaus sisältää 10 tablettia.
500 tablettia pahvikotelossa, jossa on 50 alumiini/PVC/PE/PVdC-läpipainopakkausta. Yksi läpipainopakkaus sisältää 10 tablettia.
Kaikkia pakkauskokoja ei välttämättä ole markkinoilla.
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija
Nimi: Dechra Regulatory B.V.
Osoite: Handelsweg 25
5531 AE Bladel
Alankomaat
Erän vapauttamisesta vastaava valmistaja:
Nimi: LelyPharma B.V.
Osoite: Zuiveringweg 42
8243 PZ Lelystad
Alankomaat
Nimi: Genera Inc.
Osoite: Svetonedeljska cesta 2
Kalinovica
10436 Rakov Potok
Kroatia
Painetussa pakkaussetelissä mainitaan ainoastaan tuotteen testauksen ja erien vapauttamisen sijaintipaikka.