Pakkausseloste
CLINDABACTIN purutabletti 220 mg
ELÄINLÄÄKEVALMISTEEN NIMI
Clindabactin 220 mg purutabletit koiralle
klindamysiini
VAIKUTTAVAT JA MUUT AINEET
1 purutabletti sisältää:
Vaikuttava aine:
Klindamysiini (klindamysiinihydrokloridina) 220 mg
Vaaleanruskea, pyöreä ja kupera, makuaineita sisältävä 13 mm:n purutabletti, jossa on ruskeita pilkkuja ja toisella puolella ristinmuotoinen jakouurre.
Tabletti voidaan jakaa samankokoisiin puolikkaisiin tai neljänneksiin.
KÄYTTÖAIHEET
Infektoituneiden haavojen ja paiseiden sekä suuontelon infektioiden (mukaan lukien hampaan kiinnityskudoksen sairauksien [parodontaaliset sairaudet]) hoito, kun aiheuttajana tai osallisena on klindamysiinille herkkä Staphylococcus spp., Streptococcus spp. (paitsi Streptococcus faecalis), Bacteroides spp., Fusobacterium necrophorum ja Clostridium perfringens.
Pinnallisen märkäisen ihotulehduksen (pinnallinen pyoderma) hoito, kun osallisena on klindamysiinille herkkä Staphylococcus pseudintermedius.
Klindamysiinille herkän Staphylococcus aureus -mikrobin aiheuttaman luu(ydin)tulehduksen (osteomyeliitti) hoito.
VASTA-AIHEET
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle tai apuaineille tai linkomysiinille.
Ei saa antaa kaneille, hamstereille, marsuille, chinchilloille, hevosille eikä märehtijöille, sillä näillä lajeilla klindamysiinin anto suun kautta voi aiheuttaa vaikeita ruoansulatushäiriöitä, jotka voivat johtaa eläimen kuolemaan.
HAITTAVAIKUTUKSET
Oksentelua ja ripulia on havaittu melko harvoin.
Klindamysiini aiheuttaa joskus sille epäherkkien organismien, kuten esimerkiksi resistenttien Clostridium-mikrobien ja hiivojen, liikakasvua. Superinfektiotapauksissa on ryhdyttävä asianmukaisiin toimenpiteisiin kliinisen tilanteen mukaan.
Haittavaikutusten esiintyvyys määritellään seuraavasti:
- hyvin yleinen (useampi kuin 1/10 hoidettua eläintä saa haittavaikutuksen)
- yleinen (useampi kuin 1 mutta alle 10/100 hoidettua eläintä)
- melko harvinainen (useampi kuin 1 mutta alle 10/1000 hoidettua eläintä)
- harvinainen (useampi kuin 1 mutta alle 10/10 000 hoidettua eläintä)
- hyvin harvinainen (alle 1/10.000 hoidettua eläintä, mukaan lukien yksittäiset ilmoitukset)
Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita asiasta eläinlääkärillesi. Vaihtoehtoisesti voit myös ilmoittaa kansallista raportointijärjestelmää käyttäen seuraavalle taholle: www-sivusto: www.fimea.fi/elainlaakkeet
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
KOHDE-ELÄINLAJI
Koira

ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Suun kautta.
1. Infektoituneiden haavojen ja paiseiden sekä suuontelon infektioiden (mukaan lukien hampaan kiinnityskudoksen sairauden [parodontaalinen sairaus]) hoidossa annetaan joko:
- 5,5 mg/painokilo 12 h välein 7-10 vrk ajan tai
- 11 mg/painokilo 24 h välein 7-10 vrk ajan.
Jos kliinistä vastetta ei havaita 4 vrk kuluessa, diagnoosia on harkittava uudelleen.
2. Pinnallisen märkivän ihotulehduksen (pinnallinen pyoderma) hoidossa annetaan joko:
- 5,5 mg/painokilo 12 h välein tai
- 11 mg/painokilo 24 h välein.
Koiran pinnallisen märkivän ihotulehduksen (pinnallinen pyoderma) hoidon pituudeksi suositellaan yleensä 21 vrk; tätä lyhyempi hoito tai jatkohoito kliinisen arvion mukaan.
3. Luu(ydin)tulehduksen (osteomyeliitti) hoidossa annetaan:
- 11 mg/painokilo 12 h välein vähintään 28 vrk ajan.
Jos kliinistä vastetta ei havaita 14 vrk:n kuluessa, hoito on lopetettava ja diagnoosia harkittava uudestaan.
Jotta annostus olisi oikea, eläimen paino on määritettävä mahdollisimman tarkoin aliannostelun välttämiseksi.
ANNOSTUSOHJEET
Tabletti voidaan jakaa samankokoisiin puolikkaisiin tai neljänneksiin. Aseta tabletti tasaiselle pinnalle siten, että sen jakouurteellinen puoli on ylöspäin ja kupera (pyöreä) puoli pintaa vasten.
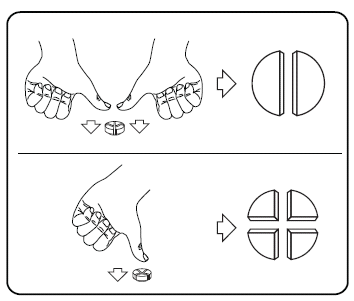
Samankokoiset puolikkaat: paina peukaloilla tabletin molempia sivuja.
Samankokoiset neljännekset: paina peukalolla tabletin keskeltä.
VAROAIKA
Ei oleellinen.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville.
Osiin jaettujen tablettien kestoaika sisäpakkauksen ensimmäisen avaamisen jälkeen: 3 vuorokautta.
Ei erityisiä säilytysohjeita.
Älä käytä tätä eläinlääkevalmistetta viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu pakkauksessa merkinnän EXP jälkeen.
Erääntymispäivällä tarkoitetaan kuukauden viimeistä päivää.
ERITYISVAROITUKSET
Eläimiä koskevat erityiset varotoimet:
Purutabletit sisältävät makuaineita. Tabletit on säilytettävä eläinten ulottumattomissa, jotta eläin ei syö tabletteja vahingossa.
Valmisteen käytön pitää perustua hoidettavasta eläimestä eristettyjen bakteerien herkkyysmääritykseen. Jos tämä ei ole mahdollista, hoidon pitää perustua paikallisiin epidemiologisiin tietoihin kohdebakteerien herkkyydestä.
Mikrobilääkehoitoja koskevat viranomaisohjeet, kansalliset ja alueelliset ohjeet on otettava huomioon valmistetta käytettäessä.
Jos valmistetta käytetään pakkausselosteen ohjeista poikkeavalla tavalla, klindamysiiniresistenttien bakteerien esiintyvyys voi suurentua. Tällöin linkomysiinin tai makrolidiantibioottien teho voi heiketä mahdollisen ristiresistenssin takia.
Linkosamidien (mukaan lukien klindamysiinin), erytromysiinin ja muiden makrolidien välillä on osoitettu olevan ristiresistenssiä.
Joissakin tapauksissa (paikalliset tai lievät leesiot; uusiutumisen ehkäisemiseksi), pinnallista märkäistä ihotulehdusta (pinnallinen pyoderma) voidaan hoitaa paikallisesti. Systeemisen mikrobihoidon tarpeen ja keston pitäisi perustua kyseisen tapauksen huolelliseen arviointiin.
Pitkäkestoisen (vähintään 1 kk) hoidon aikana maksa- ja munuaistoiminta sekä verenkuva on tutkittava säännöllisin väliajoin.
Jos eläimellä on vaikea munuaisten vajaatoiminta ja/tai hyvin vaikea maksan vajaatoiminta, johon liittyy vaikeita metabolisia poikkeavuuksia, annostuksessa on noudatettava varovaisuutta, ja suuriannoksisen klindamysiinihoidon aikana eläintä on seurattava seerumitutkimuksin.
Valmisteen käyttö vastasyntyneille ei ole suositeltavaa.
Erityiset varotoimenpiteet, joita eläinlääkevalmistetta antavan henkilön on noudatettava:
Linkosamidit (linkomysiini, klindamysiini, pirlimysiini) voivat aiheuttaa yliherkkyysoireita (allergiaoireita). Henkilöiden, jotka ovat yliherkkiä linkosamideille, tulee välttää kosketusta eläinlääkevalmisteen kanssa.
Pese kädet tablettien käsittelyn jälkeen.
Valmisteen nieleminen vahingossa voi aiheuttaa ruoansulatuskanavan haittoja, kuten esimerkiksi vatsakipua ja ripulia. Valmisteen nielemistä vahingossa on vältettävä.
Älä ota tabletteja läpipainopakkauksesta ennen kuin olet valmis antamaan annoksen eläimelle, jotta riski, että lapset nielisivät näitä tabletteja vahingossa, olisi mahdollisimman pieni. Laita osittain käytetyt tabletit takaisin läpipainopakkaukseen ja pahvikoteloon ja käytä ne seuraavalla antokerralla. Jos vahingossa nielet valmistetta (koskee erityisesti lapsia), käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Tiineys ja imetys:
Suurilla annoksilla toteutettujen rottatutkimusten tulokset viittaavat siihen, että klindamysiini ei ole teratogeeninen eikä vaikuta merkitsevästi urosten eikä naaraiden lisääntymistuloksiin. Valmisteen turvallisuutta ei kuitenkaan ole vahvistettu koiran tiineyden aikana eikä siitokseen käytettävillä uroskoirilla.
Klindamysiini läpäisee istukan ja veri-maitoesteen.
Imettävien narttukoirien hoito voi aiheuttaa pennuille ripulia.
Voidaan käyttää ainoastaan hoitavan eläinlääkärin tekemän hyöty-haitta-arvion perusteella.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Klindamysiinihydrokloridilla on todettu hermo-lihasliitosta salpaavaa vaikutusta, joka saattaa voimistaa muiden hermo-lihasliitosta salpaavien lääkeaineiden vaikutusta. Valmisteen käytössä tällaista hoitoa saaville eläimille on noudatettava varovaisuutta.
Alumiinisuolat ja -hydroksidit, kaoliini ja alumiini-magnesium-piidioksidikompleksi voivat heikentää linkosamidien imeytymistä ruoansulatuskanavasta. Nämä ruoansulatukseen vaikuttavat aineet on annettava viimeistään 2 tuntia ennen klindamysiiniä.
Klindamysiiniä ei pidä käyttää erytromysiinin tai muiden makrolidien kanssa samaan aikaan tai heti niiden jälkeen, sillä se voi johtaa makrolidiperäiseen klindamysiiniresistenssiin.
Klindamysiini voi pienentää siklosporiinin pitoisuuksia plasmassa ja aiheuttaa siten tehon heikkenemisen riskin.
Klindamysiinin ja aminoglykosidien (esim. gentamysiinin) samanaikaisen käytön aikana haitallisten yhteisvaikutusten (akuutin munuaisten vajaatoiminnan) riskiä ei voida sulkea pois.
Klindamysiiniä ei pidä käyttää samanaikaisesti kloramfenikolin eikä makrolidien kanssa, koska niidenkin vaikutuskohta on ribosomin 50S-alayksikkö ja vastakkaisvaikutuksia voi ilmetä.
Yliannostus (oireet, hätätoimenpiteet, vastalääkkeet):
Suun kautta annetut, enimmillään 300 mg/kg/vrk annokset eivät johtaneet toksisuuteen. Klindamysiiniä 600 mg/kg/vrk saaneilla koirilla esiintyi ruokahaluttomuutta, oksentelua ja painon laskua. Yliannostustapauksissa hoito lopetetaan välittömästi ja aloitetaan oireenmukainen hoito.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa heittää viemäriin eikä hävittää talousjätteiden mukana. Käyttämättömät eläinlääkevalmisteet tai niistä peräisin olevat jätemateriaalit on hävitettävä paikallisten määräysten mukaisesti.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
16.06.2020
MUUT TIEDOT
Alumiini-polyamidi/alumiini/PVC-läpipainopakkaus
Pahvikotelo, jossa on 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 tai 25 läpipainopakkausta. Kussakin läpipainopakkauksessa on 10 tablettia.
Pahvikotelo, jossa on 10 erillistä pahvikoteloa, joissa jokaisessa on 1 läpipainopakkaus. Läpipainopakkauksessa on 10 tablettia.
Kaikkia pakkauskokoja ei välttämättä ole markkinoilla.
Osiin jaettava tabletti
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija:
Dechra Regulatory B.V.
Handelsweg 25
5531 AE Bladel
Alankomaat
Erän vapauttamisesta vastaava valmistaja:
LelyPharma B.V.
Zuiveringsweg 42
8243 PZ Lelystad
Alankomaat