Pakkausseloste
VOMEND VET purutabletti 10 mg
ELÄINLÄÄKEVALMISTEEN NIMI
Vomend vet 10 mg purutabletit koiralle
VAIKUTTAVAT JA MUUT AINEET
Yksi tabletti sisältää:
Vaikuttava aine:
Metoklopramidi (hydrokloridimonohydraattina) 8,92 mg
(vastaten 10,0 mg metoklopramidihydrokloridia)
Vaaleanruskea, ruskeapilkullinen, makuainetta sisältävä, pyöreä, kupera 7 mm:n tabletti, jossa on toisella puolella ristinmuotoinen jakouurre.
Tabletti voidaan jakaa kahteen tai neljään yhtä suureen osaan.
KÄYTTÖAIHEET
Mahalaukun ja suoliston vähentyneeseen liikkeeseen liittyvien oireiden, kuten usein toistuvan oksentelun, mahalaukun laajentuman, kroonisen mahatulehduksen, pohjukaissuoli-maharefluksin (takaisinvirtauksen) ja ripulin, lievittämiseen.
VASTA-AIHEET
Ei saa käyttää tapauksissa, joissa eläimellä on mahalaukun ja suoliston verenvuotoa, puhkeama tai tukkeuma.
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle tai apuaineille.
HAITTAVAIKUTUKSET
Koira:
Hyvin harvinainen (< 1 eläin 10 000 hoidetusta eläimestä, yksittäiset ilmoitukset mukaan luettuina): | Uneliaisuus Ripuli Neurologiset vaikutukseta (levottomuus, ataksia, poikkeavat asennot ja/tai liikkeet, uupumus, vapina ja aggressiivisuus, ääntely) |
a Havaitut vaikutukset ovat ohimeneviä ja häviävät hoidon lopettamisen jälkeen.
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeen turvallisuuden jatkuvan seurannan. Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita ensisijaisesti asiasta eläinlääkärillesi. Voit ilmoittaa kaikista haittavaikutuksista myös myyntiluvan haltijalle tai myyntiluvan haltijan paikalliselle edustajalle käyttämällä tämän pakkausselosteen lopussa olevia yhteystietoja tai kansallisen ilmoitusjärjestelmän kautta:
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
www-sivusto: https://www.fimea.fi/elainlaakkeet/
KOHDE-ELÄINLAJI
Koira
ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Suun kautta.
Suositeltu annos on 0,22 mg metoklopramidia (vastaa 0,25 mg:aa metoklopramidihydrokloridia) painokiloa kohden 4 kertaa vuorokaudessa.
Seuraavassa taulukossa on eläinlääkkeen ohjeellinen annostus:
Paino kg | Annos mg/eläin* | Vomend vet 5 mg | Vomend vet 10 mg | |
| 5–7,5 | 1,25 | |||
| >7,5–12,5 | 2,5 | TAI | ||
| >12,5–17,5 | 3,75 | |||
| >17,5–22,5 | 5 | TAI | ||
| >22,5–27,5 | 6,25 | |||
| >27,5–32,5 | 7,5 | TAI | ||
| >32,5–37,5 | 8,75 | |||
| >37,5–45 | 10 | TAI | ||
| >45–55 | 12,5 | TAI | ||
| >55–65 | 15 | TAI | ||
| >65–75 | 17,5 | TAI | ||
| >75–85 | 20 | TAI |
![]() = ¼ tablettia
= ¼ tablettia ![]() = ½ tablettia
= ½ tablettia ![]() = ¾ tablettia
= ¾ tablettia ![]() = 1 tabletti
= 1 tabletti
* metoklopramidihydrokloridiannos (mg) / eläin / antokerta.
ANNOSTUSOHJEET
Tabletti voidaan jakaa kahteen tai neljään yhtä suureen osaan tarkan annostuksen varmistamiseksi. Aseta tabletti tasaiselle alustalle jakouurre ylöspäin ja kupera (pyöreä) puoli alustaa vasten.
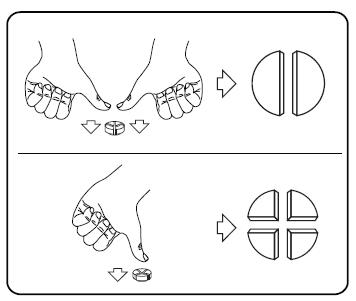
2 yhtä suurta osaa: paina peukaloilla tabletin molempia reunoja.
4 yhtä suurta osaa: paina peukalolla tabletin keskeltä.
VAROAIKA
Ei oleellinen.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville.
Älä käytä tätä eläinlääkettä viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu ulkopakkauksessa merkinnän Exp. jälkeen. Viimeisellä käyttöpäivämäärällä tarkoitetaan kuukauden viimeistä päivää.
Jaettujen tablettien kestoaika: 3 vuorokautta.
Laita käyttämättä jääneet tabletin osat takaisin avattuun läpipainopakkaukseen ja pahvikoteloon.
ERITYISVAROITUKSET
Erityisvaroitukset:
Ei saa käyttää alle 10 kg:n painoisille koirille.
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:
Vältä antamista eläimille, joilla on sairaus, johon liittyy kouristuskohtauksia, kuten epilepsia, tai pään vamma.
Metoklopramidi voi suurentaa prolaktiinipitoisuutta, joten sen käytössä on oltava varovainen, jos koiralla on valeraskaus.
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Eläinlääke voi vahingossa nieltynä aiheuttaa neurologisia vaikutuksia etenkin lapsille.
Lapsia ei saa päästää kosketuksiin tämän eläinlääkkeen kanssa. Pane käyttämättä jääneet tablettien osat takaisin avattuun läpipainopaikkaukseen ja kartonkikoteloon, pidä ne tarkoin poissa lasten ulottuvilta ja käytä ne seuraavalla antokerralla.
Jos vahingossa nielet valmistetta, käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Tiineys ja laktaatio:
Eläinlääkkeen turvallisuutta tiineyden ja laktaation aikana ei ole selvitetty. Voidaan käyttää ainoastaan hoitavan eläinlääkärin tekemän hyöty-riskiarvion perusteella.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Jos eläimellä on mahatulehdus, vältä lääkkeen käyttöä samanaikaisesti antikolinergisten lääkkeiden (atropiini) kanssa, koska ne voivat kumota metoklopramidin vaikutukset mahalaukun ja suoliston motiliteettiin.
Samanaikaisen ripulin yhteydessä antikolinergisten lääkkeiden käytölle ei ole vasta-aihetta.
Metoklopramidin samanaikainen käyttö fentiatsiinipohjaisten neuroleptien (asepromatsiini) ja butyrofenonien kanssa lisää neurologisten vaikutusten riskiä (ks. kohta Haittatapahtumat).
Metoklopramidi saattaa voimistaa keskushermostoa lamaavien aineiden vaikutusta. Samanaikaisen käytön yhteydessä on suositeltavaa käyttää pienintä metoklopramidiannosta liiallisen sedaation välttämiseksi.
Yliannostus:
Yliannostustapauksessa ei ole havaittu muita kuin kohdassa Haittatapahtumat lueteltuja haittavaikutuksia.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia kansallisia keräysjärjestelmiä. Näiden toimenpiteiden avulla voidaan suojella ympäristöä.
Kysy käyttämättömien lääkkeiden hävittämisestä eläinlääkäriltäsi tai apteekista.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
21.07.2025
Tätä eläinlääkettä koskevaa yksityiskohtaista tietoa on saatavilla unionin valmistetietokannassa (https://medicines.health.europa.eu/veterinary).
MUUT TIEDOT
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija:
Dechra Regulatory B.V.
Handelsweg 25
5531 AE Bladel
Alankomaat
Erän vapauttamisesta vastaava valmistaja:
Lelypharma B.V.
Zuiveringsweg 42
8243 PZ Lelystad
Alankomaat
Tai
Genera d.d.
Svetonedeljska cesta 2, Kalinovica
10436 Rakov Potok
Kroatia
Paikalliset edustajat ja yhteystiedot epäillyistä haittatapahtumista ilmoittamista varten:
Dechra Veterinary Products Oy
Linnoitustie 4
02600 ESPOO
Suomi
Puh.: +358 (0)22510500
Lisätietoja tästä eläinlääkkeestä saa myyntiluvan haltijan paikalliselta edustajalta.