Pakkausseloste
CEFABACTIN VET tabletti 1000 mg
ELÄINLÄÄKEVALMISTEEN NIMI
Cefabactin vet 1000 mg tabletit koiralle
kefaleksiini
VAIKUTTAVAT JA MUUT AINEET
Yksi tabletti sisältää:
Vaikuttava aine:
Kefaleksiini (kefaleksiinimonohydraattina) 1000 mg
Vaaleanruskea ruskeapilkullinen tabletti, joka on muodoltaan pyöreä ja kupera ja jonka toisella puolella on ristin muotoinen jakouurre. Tabletissa on makuainetta.
Tabletin voi jakaa 2 tai 4 yhtä suureen osaan.
KÄYTTÖAIHEET
Seuraavien sairauksien hoitoon:
- hengitystieinfektiot, erityisesti bronkopneumonia, jonka aiheuttajia ovat Staphylococcus aureus, Streptococcus-lajit, Escherichia coli tai Klebsiella-lajit
- virtsatieinfektiot, joiden aiheuttajia ovat Escherichia coli, Proteus-lajit tai Staphylococcus-lajit
- ihoinfektiot, joiden aiheuttajia ovat Staphylococcus-lajit.
VASTA-AIHEET
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle, muille kefalosporiineille, muille beetalaktaamiryhmän aineille tai apuaineille.
Ei saa käyttää tapauksissa, joissa kefalosporiini- tai penisilliiniresistenssi on tiedossa.
Ei saa antaa kaneille, marsuille, hamstereille eikä gerbiileille.
HAITTAVAIKUTUKSET
Kefaleksiinia sisältävillä valmisteilla hoidetuilla koirilla on havaittu ilmenevän toisinaan oksentelua. Ripulia voi ilmetä, kuten muidenkin antibioottihoitojen yhteydessä. Jos oksentelu ja/tai ripuli on toistuvaa, hoito on keskeytettävä ja hoitavalta eläinlääkäriltä on kysyttävä ohjeita. Uneliaisuutta saattaa esiintyä hyvin harvoin.
Yliherkkyyttä voi esiintyä harvoin. Jos yliherkkyysreaktioita ilmenee, hoito on keskeytettävä.
Haittavaikutusten esiintyvyys määritellään seuraavasti:
- hyvin yleinen (useampi kuin 1/10 hoidettua eläintä saa haittavaikutuksen)
- yleinen (useampi kuin 1 mutta alle 10/100 hoidettua eläintä)
- melko harvinainen (useampi kuin 1 mutta alle 10/1 000 hoidettua eläintä)
- harvinainen (useampi kuin 1 mutta alle 10/10 000 hoidettua eläintä)
- hyvin harvinainen (alle 1/10 000 hoidettua eläintä, mukaan lukien yksittäiset ilmoitukset).
Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita asiasta eläinlääkärillesi.
Vaihtoehtoisesti voit ilmoittaa kansallista raportointijärjestelmää käyttäen www.fimea.fi/elainlaakkeet/
KOHDE-ELÄINLAJI
Koira.
ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Suun kautta.
Suositeltu annos on 15–30 mg kefaleksiinia painokiloa kohti kahdesti vuorokaudessa vähintään 5 peräkkäisen päivän ajan. Vastaava eläinlääkäri voi määrätä pidemmän hoidon esimerkiksi silloin, kun kyse on virtsatieinfektioista tai bakteeriperäisestä dermatiitista.
Oikean annoksen varmistamiseksi ja aliannostuksen välttämiseksi eläimen paino on määritettävä mahdollisimman tarkasti.
Seuraava taulukko on tarkoitettu ohjeeksi valmisteen annosteluun annoksella 15 mg kefaleksiinia painokiloa kohti kahdesti vuorokaudessa.
ANTO KAHDESTI VUOROKAUDESSA
| |||||
| Paino | Annos (mg) | Cefabactin vet 50 mg | Cefabactin vet 250 mg | Cefabactin vet 500 mg | Cefabactin vet 1 000 mg |
| > 0,5–0,8 kg | 12,5 | - | - | - | |
| > 0,8–1,6 kg | 25 | - | - | - | |
| > 1,6–2,5 kg | 37,5 | - | - | - | |
| > 2,5–3,3 kg | 50 | - | - | - | |
| > 3,3–5 kg | 75 | - | - | - | |
| > 5–6,6 kg | 100 | - | - | - | |
| > 6,6–8 kg | 125 | - | - | ||
| > 8–10 kg | 150 | - | - | - | |
| > 10–12,5 kg | 188 | - | - | - | |
| > 12,5–16,6 kg | 250 | - | - | ||
| > 16,6–20 kg | 313 | ||||
| > 20–25 kg | 375 | - | - | - | |
| > 25–29 kg | 438 | - | - | - | |
| > 29–33 kg | 500 | - | |||
| > 33–41 kg | 625 | - | - | - | |
| > 41–50 kg | 750 | - | - | ||
| > 50–58 kg | 875 | - | - | - | |
| > 58–66 kg | 1 000 | - | - | ||
| > 66–83 kg | 1 250 | - | - | - | |
![]() = ¼ tabletti
= ¼ tabletti ![]() = ½ tabletti
= ½ tabletti ![]() = ¾ tabletti
= ¾ tabletti ![]() = 1 tabletti
= 1 tabletti
ANNOSTUSOHJEET
Tabletit voidaan jakaa 2 tai 4 yhtä suureen osaan tarkan annostelun takaamiseksi. Aseta tabletti tasaiselle pinnalle niin, että jakouurre osoittaa ylöspäin.
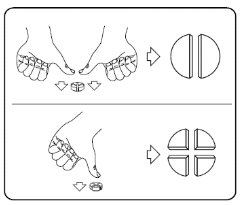
Jos haluat puolittaa tabletin, paina tablettia peukaloilla alaspäin sen kummaltakin reunalta.
Jos haluat jakaa tabletin neljään osaan, paina tablettia peukalolla alaspäin sen keskikohdasta.
VAROAIKA
Ei oleellinen.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville.
Sisäpakkauksen ensimmäisen avaamisen jälkeinen, jaettuja tabletteja koskeva kestoaika: 4 vuorokautta.
Tämä lääkevalmiste ei vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Älä käytä tätä eläinlääkevalmistetta viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu pakkauksessa Käyt.viim. -merkinnän jälkeen.
Erääntymispäivällä tarkoitetaan kuukauden viimeistä päivää.
ERITYISVAROITUKSET
Eläimiä koskevat erityiset varotoimet
Koska kefaleksiinille resistenttien bakteerien esiintyvyydessä on todennäköisesti (ajallista ja maantieteellistä) vaihtelua, suositellaan bakteerinäytteen ottoa ja herkkyysmäärityksen tekemistä.
Eläinlääkevalmistetta on käytettävä vain eläimistä eristettyjen bakteerien herkkyysmäärityksen perusteella. Jos tämä ei ole mahdollista, hoidon on pohjauduttava paikallisiin epidemiologiatietoihin. Eläinlääkevalmistetta käytettäessä on otettava huomioon viralliset, kansalliset ja alueelliset mikrobilääkkeiden käyttöä koskevat toimintaperiaatteet.
Tämän pakkausselosteen ohjeista poikkeava valmisteen käyttö saattaa lisätä kefaleksiinille resistenttien bakteerien yleisyyttä ja heikentää muilla beetalaktaamiantibiooteilla tapahtuvan hoidon tehoa mahdollisen ristiresistenssin vuoksi.
Jos eläimellä on krooninen munuaisten vajaatoiminta, annosta tulee pienentää tai annosväliä kasvattaa. Tableteissa on makuainetta. Säilytä tabletteja eläinten ulottumattomissa, etteivät eläimet syö niitä vahingossa.
Erityiset varotoimenpiteet, joita eläinlääkevalmistetta antavan henkilön on noudatettava
Penisilliinit ja kefalosporiinit voivat aiheuttaa yliherkkyyttä (allergiaa) injisoinnin, hengittämisen, nielemisen tai ihokosketuksen seurauksena. Yliherkkyys penisilliinille voi aiheuttaa ristireaktion kefalosporiinille ja päinvastoin. Allergiset reaktiot näille aineille voivat joskus olla vakavia. Älä käsittele tätä eläinlääkevalmistetta, jos tiedät olevasi herkistynyt sille tai jos sinua on kehotettu välttämään kosketusta tällaisten aineiden kanssa.
Käsittele tätä eläinlääkevalmistetta hyvin varovaisesti, jotta et altistuisi sille, ja huolehdi kaikista suositelluista varotoimista. Jos sinulle kehittyy altistuksen jälkeen oireita, kuten ihottumaa, käänny lääkärin puoleen ja näytä hänelle tämä varoitus. Kasvojen, huulten tai silmien alueen turvotus taikka hengitysvaikeudet ovat vakavampia oireita ja vaativat kiireellistä lääkärinhoitoa.
Jaetut tai käyttämättömät tabletit on palautettava avoimeen läpipainotaskuun ja asetettava takaisin ulkopakkaukseen, jotta lapset eivät pääse vahingossa nielemään tuotetta.
Jos valmistetta on nielty vahingossa, on käännyttävä välittömästi lääkärin puoleen ja näytettävä tälle pakkausselostetta tai myyntipäällystä.
Pese kädet käytön jälkeen.
Tiineys ja laktaatio
Laboratoriotutkimuksissa rotilla ja hiirillä ei ole löydetty näyttöä epämuodostumia aiheuttavista vaikutuksista.
Eläinlääkevalmisteen turvallisuutta koirien hoidossa tiineyden ja laktaation aikana ei ole selvitetty. Voidaan käyttää ainoastaan hoitavan eläinlääkärin tekemän hyöty-haitta‑arvion perusteella.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset
Tehon varmistamiseksi eläinlääkevalmistetta ei saa käyttää yhdessä bakteerien kasvua ja lisääntymistä estävien antibioottien (makrolidit, sulfonamidit ja tetrasykliinit) kanssa.
Ensimmäisen polven kefalosporiinien samanaikainen käyttö aminoglykosidiantibioottien tai joidenkin virtsaneritystä lisäävien lääkeaineiden, kuten furosemidin, kanssa saattaa lisätä munuaismyrkyllisyyden riskiä.
Yliannostus (oireet, hätätoimenpiteet, vastalääkkeet)
Muita kuin kohdassa Haittavaikutukset mainittuja haittavaikutuksia ei tunneta.
Yliannostustapauksessa hoidon on oltava oireenmukaista.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa heittää viemäriin eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä eläinlääkäriltä tai apteekista. Nämä toimenpiteet on tarkoitettu ympäristön suojelemiseksi.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
11.05.2023
MUUT TIEDOT
Pahvirasia, jossa 1,2,3,4,5,6,7,8,9,10 tai 25 läpipainopakkausta, joissa kussakin 10 tablettia.
Pahvirasia, jossa 10 erillistä pahvirasiaa, joissa kussakin on yksi 10 tabletin läpipainopakkaus.
Kaikkia pakkauskokoja ei välttämättä ole markkinoilla.
Jaettava tabletti
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija:
Le Vet. Beheer B.V.
Wilgenweg 7, 3421 TV Oudewater, Alankomaat
Erän vapauttamisesta vastaava valmistaja:
LelyPharma B.V.
Zuiveringweg 42, 8243 PZ Lelystad, Alankomaat