Pakkausseloste
NEPTRA korvatipat, liuos, kerta-annospakkaus 16,7/16,7/2,2 mg
ELÄINLÄÄKEVALMISTEEN NIMI
Neptra korvatipat, liuos koiralle
VAIKUTTAVAT JA MUUT AINEET
Yksi annos (1 ml) sisältää:
Vaikuttavat aineet:
Florfenikoli (florfenicol): 16,7 mg
Terbinafiinihydrokloridi (terbinafine hydrochloride): 16,7 mg, vastaten terbinafiiniemästä: 14,9 mg
Mometasonifuroaatti (mometasone furoate): 2,2 mg
Kirkas, väritön tai keltainen, hieman viskoosinen neste.
KÄYTTÖAIHEET
Koiran akuutin ulkokorvatulehduksen ja akuutisti pahentuneen toistuvan korvatulehduksen hoitoon, kun aiheuttajina ovat Staphylococcus pseudintermedius ‑bakteerin ja Malassezia pachydermatis ‑hiivasienen aiheuttamat sekainfektiot.
VASTA-AIHEET
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttaville aineille, muille kortikosteroideille tai apuaineille.
Ei saa käyttää, jos tärykalvo on puhjennut.
Ei saa käyttää koirille, joilla on yleistynyt demodikoosi (sikaripunkki).
Ei saa käyttää tiineille eläimille eikä siitoseläimille.
HAITTAVAIKUTUKSET
Koira:
| Hyvin harvinainen (< 1 eläin 10 000 hoidetusta eläimestä, yksittäiset ilmoitukset mukaan luettuina): |
| Antokohdan punoitus, antokohdan tulehdus, antokohdan kipu1 Hyperaktiivisuus, ääntely1 Oksentelu Kuurous2, kuulon heikkeneminen2, sisäkorvan häiriö, pään pudisteleminen1 Silmähäiriö (kuten luomikouristus, sidekalvotulehdus, sarveiskalvon haavauma, silmien ärsytys, kuivasilmäisyys) Haparointi, silmävärve Ruokahaluttomuus |
1 Havaittu ilmenevän pian eläinlääkkeen annon jälkeen.
2 Pääasiassa vanhoilla eläimillä.
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeen turvallisuuden jatkuvan seurannan. Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita ensisijaisesti asiasta eläinlääkärillesi. Voit ilmoittaa kaikista haittavaikutuksista myös myyntiluvan haltijalle käyttämällä tämän pakkausselosteen lopussa olevia yhteystietoja tai kansallisen ilmoitusjärjestelmän kautta: {kansallisen järjestelmän yksityiskohdat}.
KOHDE-ELÄINLAJI
Koira. ![]()
ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Korvaan.
Kertahoito.
Suositusannos on 1 kerta-annospakkaus (eli 1 ml liuosta) tulehtuneeseen korvaan.
Maksimaalinen hoitovaste saavutetaan mahdollisesti vasta 28 vuorokauden kuluttua lääkkeen antamisesta.
Ravista hyvin ennen käyttöä 5 sekunnin ajan.
Pidä kerta-annospakkausta pystyasennossa ja poista pakkauksen korkki.
Käytä korkin yläosaa apunasi ja riko sinetti kokonaan. Irrota sitten korkki kerta-annospakkauksesta.
Kiinnitä annostelukärki kerta-annospakkaukseen. Laita annostelukärki tulehtuneen korvan ulkokorvakäytävään ja purista kerta-annospakkauksen koko sisältö korvaan.
Kuvalliset ohjeet ovat jäljempänä.
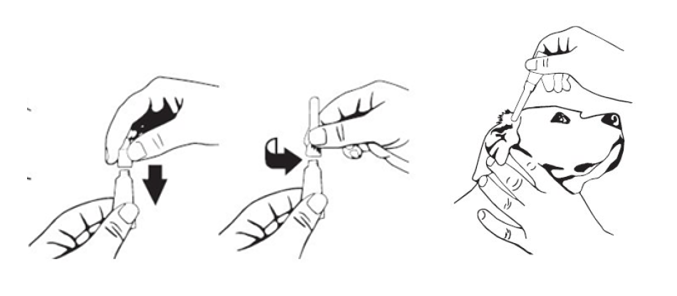
ANNOSTUSOHJEET
Puhdista ulkokorvakäytävä keittosuolaliuoksella ja kuivaa se ennen valmisteen antamista.
Kun olet annostellut valmisteen, hiero korvan tyveä kevyesti 30 sekunnin ajan, jotta valmiste leviää. Pidä koiran päästä kiinni 2 minuutin ajan, jotta koira ei pääse pudistelemaan päätään.
VAROAIKA
Ei oleellinen.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville.
Älä säilytä yli 25 ºC.
Älä käytä tätä eläinlääkettä viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu pahvikotelossa ja pakkauksen etiketissä merkinnän Exp. jälkeen. Viimeisellä käyttöpäivämäärällä tarkoitetaan kuukauden viimeistä päivää.
ERITYISVAROITUKSET
Erityisvaroitukset:
Bakteerien ja sienten aiheuttama korvatulehdus on usein toissijainen. Sairauden taustalla olevat syyt, kuten allergia tai korvan anatominen muoto, on huomioitava eläimillä, joilla on aiemmin ollut toistuva ulkokorvantulehdus, jotta voidaan välttää tehoton hoito eläinlääkkeellä.
Jos kyseessä on loisen aiheuttama korvatulehdus, pitää aloittaa asianmukainen loislääkehoito.
Korvat on puhdistettava ennen valmisteen antamista. Korvien puhdistamista uudelleen suositellaan aikaisintaan 28 vuorokauden kuluttua valmisteen antamisesta. Kliinisissä tutkimuksissa korvat puhdistettiin pelkästään keittosuolaliuoksella ennen hoidon aloittamista.
Tämä yhdistelmä on tarkoitettu akuutin korvatulehduksen hoitoon, kun on todettu florfenikolille herkän Staphylococcus pseudintermediuksen ja terbinafiinille herkän Malassezia pachydermatiksen aiheuttamia sekainfektiota.
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:
Eläinlääkkeen turvallisuutta alle 3 kuukauden ikäisten koirien hoidossa ei ole selvitetty. Valmisteen turvallisuutta alle 4 kg:n painoisten koirien hoidossa ei ole selvitetty. Kenttätutkimuksissa ei kuitenkaan havaittu turvallisuusongelmia alle 4 kg;n painoisilla koirilla.
Ennen eläinlääkkeen käyttöä ulompi korvakäytävä on tutkittava perusteellisesti ja varmistettava, ettei tärykalvo ole puhjennut.
Arvioi koira uudelleen, jos hoidon aikana havaitaan kuulon heikkenemistä tai merkkejä korvan tasapainoelimen häiriöstä.
Valmisteen antamisen jälkeen korvat saattavat olla märät tai niistä saattaa tulla kirkasta eritettä. Tämä ei liity taudin patologiaan.
Valmisteen käytön pitää perustua kohdepatogeeni(e)n tunnistamiseen ja herkkyystestaukseen. Jos tämä ei ole mahdollista, hoidon pitää perustua epidemiologisiin tietoihin ja paikalliseen/alueelliseen tietoon kohdepatogeenien herkkyydestä.
Valmisteen käytössä on noudatettava virallisia kansallisia ja alueellisia ohjeita mikrobilääkkeiden käytöstä.
Ensilinjan hoitona on käytettävä antibioottia, johon liittyy pienempi mikrobilääkeresistenssin valikoitumisen riski (alempi AMEG-luokitus) silloin kun herkkyysmääritys viittaa tällaisen hoidon todennäköiseen tehoon.
Pakkausselosteen ohjeista poikkeava eläinlääkkeen käyttö saattaa lisätä florfenikolille vastustuskykyisten bakteerien ja terbinafiinille vastustuskykyisten sienten esiintyvyyttä sekä heikentää muiden antibioottien ja sienilääkkeiden tehoa.
Siedettävyystutkimuksissa havaittiin pienentyneitä kortisolipitoisuuksia valmisteen annon jälkeen (ennen ACTH-stimulaatiota ja sen jälkeen). Tämä viittaa siihen, että mometasonifuroaatti imeytyy systeemiseen verenkiertoon. Pääasialliset löydökset, joita havaittiin kerta-annoksella, olivat kortikaalisen vasteen pieneneminen ACTH-stimulaatiolle, pienentyneet absoluuttiset lymfosyytti- ja eosinofiiliarvot sekä lisämunuaisen painon väheneminen. Kortikosteroideja sisältävien paikallishoitovalmisteiden pitkäaikaisen ja intensiivisen käytön on todettu aiheuttavan systeemisiä vaikutuksia, esimerkiksi heikentävän lisämunuaisten toimintaa (ks. kohta Yliannostus).
Jos yliherkkyyttä jollekin ainesosalle ilmenee, korva on pestävä huolellisesti. Muiden kortikosteroidien samanaikaista käyttöä pitää välttää.
Käytettävä varoen koirille, joilla epäillään olevan tai on todettu umpierityssairaus (esim. sokeritauti, kilpirauhasen vajaa- tai liikatoiminta, jne.).
Varovaisuutta on noudatettava, ettei eläinlääkettä mene hoidettavan koiran silmiin. Koiraa on esim. estettävä pudistelemasta päätään (ks. kohta Annostusohjeet). Jos valmistetta joutuu silmiin, huuhtele huolellisesti vedellä.
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Eläinlääke voi ärsyttää voimakkaasti silmiä. Valmistetta voi vahingossa joutua silmiin, jos koira ravistelee päätään valmistetta annettaessa tai heti sen jälkeen. Omistajiin kohdistuvan riskin välttämiseksi suositellaan, että tämän eläinlääkkeen antaa vain eläinlääkäri tai että anto tapahtuu eläinlääkärin tarkassa valvonnassa. Sopivat varotoimet (kuten suojalasien käyttö eläinlääkettä annettaessa, korvakäytävän huolellinen hieronta annon jälkeen, jotta valmiste leviäisi tasaisesti, koiran pitäminen paikallaan annon jälkeen) ovat tarpeen, jotta vältettäisiin valmisteen joutuminen silmiin. Jos valmistetta joutuu vahingossa silmiin, niitä pitää huuhdella runsaalla vedellä 10–15 minuutin ajan. Jos oireita ilmenee, on käännyttävä lääkärin puoleen ja näytettävä hänelle pakkausseloste tai myyntipäällys.
Vaikka kokeellisissa tutkimuksissa ei todettu ihoärsytystä, pitää valmisteen joutumista iholle välttää. Jos valmistetta joutuu vahingossa ihollesi, huuhtele alue huolellisesti vedellä.
Saattaa olla haitallista nieltynä. Vältä valmisteen joutumista suuhun, myös käsien kautta. Jos vahingossa nielet valmistetta, käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Muut varotoimet:
Tämän eläinlääkkeen turvallisuutta ja tehoa kissoille ei ole arvioitu. Valmisteen markkinoille tulon jälkeinen seuranta osoittaa, että valmisteen käyttöön kissoille voi liittyä neurologisia oireita (mukaan lukien haparointi, Hornerin oireyhtymä ja siihen liittyvä vilkkuluomen esiintulo, mustuaisten pienuus, mustuaisten erikokoisuus), sisäkorvan häiriöitä (pään pitäminen kallellaan) ja yleisoireita (ruokahaluttomuus ja unisuus). Tämän eläinlääkkeen käyttöä kissoille pitää siksi välttää.
Tiineys ja laktaatio:
Eläinlääkkeen turvallisuutta tiineyden ja laktaation aikana ei ole selvitetty. Ei saa käyttää tiineyden ja laktaation aikana.
Hedelmällisyys:
Vaikutuksia koirien hedelmällisyyteen ei ole tutkittu. Ei saa käyttää siitoseläimille.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Ei tunneta.
Yhteensopivuutta muiden korvanpuhdistusvalmisteiden, paitsi keittosuolaliuoksen, kanssa ei ole osoitettu.
Yliannostus:
Valmiste oli hyvin siedettyä, kun sitä annosteltiin korvaan enintään viisinkertainen annos suositusannokseen nähden joka toinen viikko yhteensä kolmen hoitokerran ajan. Huomattavimmat vaikutukset olivat samansuuntaisia glukokortikoidin annon kanssa; erityisiä havaintoja olivat muun muassa lisämunuaisen kortikaalisen vasteen heikentyminen ACTH-stimulaatiolle, lisämunuaisen painon väheneminen ja lisämunuaiskuoren surkastuminen, pienentyneet absoluuttiset lymfosyytti- ja eosinofiiliarvot, suurentunut absoluuttinen neutrofiiliarvo, maksan painon suureneminen sekä hepatosellulaarinen kasvu / sytoplasminen muutos ja kateenkorvan painon väheneminen. Muita mahdollisesti hoitoon liittyviä vaikutuksia olivat muun muassa aspartaattiaminotransferaasin (ASAT), kokonaisproteiinin, kolesterolin, epäorgaanisen fosforin, kreatiniinin ja kalsiumin lievät muutokset. Kun valmistetta oli annettu kolme kertaa viikon välein enintään viisinkertainen annos suositusannokseen nähden, valmiste aiheutti lievää punoitusta yhdessä tai molemmissa korvissa. Vaikutus normalisoitui 48 tunnin kuluessa.
Käyttöä koskevat erityiset rajoitukset ja erityiset ehdot:
Eläinlääkärin annettavaksi tai eläinlääkärin tarkassa valvonnassa annettavaksi.
Merkittävät yhteensopimattomuudet:
Koska yhteensopimattomuustutkimuksia ei ole tehty, eläinlääkettä ei saa sekoittaa muiden eläinlääkkeiden kanssa.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia kansallisia keräysjärjestelmiä. Näiden toimenpiteiden avulla voidaan suojella ympäristöä.
Kysy käyttämättömien lääkkeiden hävittämisestä eläinlääkäriltäsi tai apteekista.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
05/2025
Tätä eläinlääkettä koskevaa yksityiskohtaista tietoa on saatavilla unionin valmistetietokannassa (https://medicines.health.europa.eu/veterinary).
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija ja yhteystiedot epäillyistä haittatapahtumista ilmoittamista varten:
Elanco Animal Health GmbH, Alfred-Nobel-Str. 50, 40789 Monheim, Saksa
België/Belgique/Belgien Tél/Tel: +32 33000338 | Lietuva Tel: +372 8840389 |
Република България Teл: +48 221047815 | Luxembourg/Luxemburg Tél/Tel: +352 20881943 |
Česká republika Tel: +420 228880231 | Magyarország Tel.: +36 18506968 |
Danmark Tlf: +45 78775477 | Malta Tel: +36 18088530 |
Deutschland Tel: +49 32221852372 | Nederland Tel: +31 852084939 |
Eesti Tel: +372 8807513 | Norge Tlf: +47 81503047 |
Ελλάδα Τηλ: +386 82880097 | Österreich Tel: +43 720116570 |
España Tel: +34 518890402 | Polska Tel.: +48 221047306 |
France Tél: +33 975180507 | Portugal Tel: +351 308801355 |
Hrvatska Tel: +36 18088411 | România Tel: +40 376300400 |
Ireland Tel: +44 3308221732 | Slovenija Tel: +386 82880093 |
Ísland Sími: +45 89875379 | Slovenská republika Tel: +420 228880231 |
Italia Tel: +39 0282944231 | Suomi/Finland Puh/Tel: +358 753252088 |
Κύπρος Τηλ: +386 82880095 | Sverige Tel: +46 108989397 |
Latvija Tel: +372 8840390 | United Kingdom (Northern Ireland) Tel: +44 3308221732 |
Erän vapauttamisesta vastaava valmistaja:
KVP Pharma + Veterinär Produkte GmbH, Projensdorfer Str. 324, 24106 Kiel, Saksa