Pakkausseloste
THALIDOMIDE BMS kapseli, kova 50 mg
VAROITUS
Talidomidi aiheuttaa synnynnäisiä vaurioita ja sikiökuolemia. Älä ota talidomidia, jos olet raskaana tai voit tulla raskaaksi. Sinun on noudatettava lääkärisi antamaa ehkäisyneuvontaa.
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen ottamisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Thalidomide BMS on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin otat Thalidomide BMS ‑valmistetta
3. Miten Thalidomide BMS ‑valmistetta otetaan
4. Mahdolliset haittavaikutukset
5. Thalidomide BMS ‑valmisteen säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mitä Thalidomide BMS on
Thalidomide BMS sisältää vaikuttavaa ainetta, jonka nimi on talidomidi. Se kuuluu sellaisten lääkkeiden ryhmään, jotka vaikuttavat immuunijärjestelmän toimintaan.
Mihin Thalidomide BMS ‑valmistetta käytetään
Thalidomide BMS ‑valmistetta käytetään yhdessä kahden muun lääkkeen, melfalaanin ja prednisonin, kanssa aikuisille, joilla on multippeliksi myeloomaksi kutsuttu syöpä. Sitä käytetään äskettäin diagnosoiduille, 65‑vuotiaille tai sitä vanhemmille potilaille, joiden multippelin myelooman hoitoon ei ole aikaisemmin määrätty muuta lääkettä, tai alle 65-vuotiaille potilaille, joita ei voida hoitaa suurilla solunsalpaaja-annoksilla, joista aiheutuu elimistölle hyvin voimakas rasitus.
Mikä multippeli myelooma on
Multippeli myelooma on syöpätyyppi, joka vaikuttaa tietyntyyppisiin veren valkosoluihin, joita kutsutaan plasmasoluksi. Nämä solut kerääntyvät luuytimeen ja jakautuvat hallitsemattomasti. Tämä voi vaurioittaa luustoa ja munuaisia. Multippelia myeloomaa ei yleensä voida parantaa. Sen oireita ja löydöksiä voidaan kuitenkin vähentää huomattavasti tai saada ne häviämään joksikin aikaa. Tätä kutsutaan remissioksi.
Miten Thalidomide BMS vaikuttaa
Thalidomide BMS toimii auttamalla elimistön immuunijärjestelmää ja vaikuttamalla suoraan syöpään. Se vaikuttaa monin tavoin:
- estämällä syöpäsolujen kehittymisen
- estämällä verisuonten kasvun syöpäkasvaimessa
- stimuloimalla immuunijärjestelmää taistelemaan syöpäsoluja vastaan.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Lääkärisi on antanut sinulle erityisohjeet koskien erityisesti talidomidin vaikutuksia sikiöön (selitetty Thalidomide BMS ‑valmisteen raskauden ehkäisyohjelmassa).
Lääkärisi on antanut sinulle potilastiedotteen. Lue se huolellisesti ja noudata asiaankuuluvia ohjeita.
Jos et täysin ymmärrä näitä ohjeita, pyydä lääkäriäsi selittämään ne uudelleen ennen kuin otat talidomidia. Katso myös lisätietoja tämän kappaleen kohdista ”Varoitukset ja varotoimet” ja ”Raskaus ja imetys”.
Älä ota Thalidomide BMS ‑valmistetta
- jos olet raskaana tai epäilet olevasi raskaana tai suunnittelet raskautta, sillä Thalidomide BMS aiheuttaa synnynnäisiä vaurioita ja sikiökuolemia
- jos voit tulla raskaaksi, ellet pysty noudattamaan vaadittuja raskaudenehkäisymenetelmiä (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä ”Varoitukset ja varotoimet” ja ”Raskaus ja imetys”)
- jos voit tulla raskaaksi, lääkäri tekee kunkin lääkemääräyksen yhteydessä merkinnän siitä, että tarvittavia toimenpiteitä on noudatettu ja antaa sinulle siitä vahvistuksen.
- jos olet allerginen talidomidille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa.)
Älä ota Thalidomide BMS ‑valmistetta, jos jokin edellä mainituista koskee sinua. Jos olet epävarma, keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin otat Thalidomide BMS -valmistetta.
Varoitukset ja varotoimet
Keskustele lääkärin, apteekkihenkilökunnan tai sairaanhoitajan kanssa ennen kuin otat tätä lääkettä seuraavissa tilanteissa:
Naiset, jotka ottavat Thalidomide BMS ‑valmistetta
Ennen hoidon aloittamista, sinun pitää kysyä lääkäriltäsi, onko mahdollista, että voit tulla raskaaksi, vaikka luulet, että se on epätodennäköistä. Raskaaksi tuleminen on mahdollista, vaikka kuukautisesi olisivat jääneet pois syöpähoidon jälkeen.
Jos on mahdollista, että tulet raskaaksi:
- Lääkärisi varmistaa, että sinulle tehdään raskaustesti
- ennen hoidon aloittamista
- 4 viikon välein hoidon aikana
- 4 viikkoa hoidon lopettamisen jälkeen
- Sinun täytyy käyttää tehokasta ehkäisymenetelmää
- vähintään 4 viikkoa ennen hoidon aloittamista
- hoidon aikana
- siihen asti, kunnes hoidon lopettamisesta on kulunut vähintään 4 viikkoa
Lääkärisi kertoo, mitä ehkäisymenetelmää sinun pitää käyttää.
Jos voit tulla raskaaksi, lääkärisi kirjaa jokaisen reseptin yhteydessä, että edellä kuvatut tarvittavat toimenpiteet on tehty.
Miehet, jotka ottavat Thalidomide BMS ‑valmistetta
Talidomidia erittyy spermaan. Sen vuoksi et saa olla suojaamattomassa yhdynnässä, vaikka sinulle olisi tehty siemenjohtimen katkaisu ja osapoisto.
- Raskautta ja kaikkea raskaudenaikaista altistamista on vältettävä. Käytä aina kondomia:
- hoidon aikana
- vähintään 7 päivän ajan hoidon lopettamisen jälkeen
- Sinä et saa luovuttaa spermaa:
- hoidon aikana
- vähintään 7 päivään hoidon lopettamisen jälkeen
Kaikki potilaat
Keskustele lääkärin kanssa, ennen kuin otat Thalidomide BMS ‑valmistetta, jos
- et ymmärrä lääkärin sinulle antamia neuvoja raskauden ehkäisystä tai jos epäilet, ettet pysty noudattamaan neuvoja
- sinulla on joskus aiemmin ollut sydänkohtaus, on joskus ollut veritulppa tai jos tupakoit, sinulla on korkea verenpaine tai korkeat kolesteroliarvot. Sinulla on Thalidomide BMS ‑hoidon aikana tavallista suurempi laskimo- ja valtimoveritulppien kehittymisen vaara (ks. myös kohta Mahdolliset haittavaikutukset)
- sinulla on ollut tai on parhaillaan neuropatiaa eli hermovaurio, joka aiheuttaa kihelmöintiä, koordinaation poikkeavuuksia tai kipua käsissä tai jaloissa (ks. myös kohta Mahdolliset haittavaikutukset)
- sydämesi rytmi on ollut tai on parhaillaan hidas (tämä saattaa olla bradykardian eli hidaslyöntisyyden oire)
- sinulla on korkea verenpaine keuhkoverisuonissa (ks. myös kohta Mahdolliset haittavaikutukset)
- sinulla esiintyy veren valkosolujen vähenemistä (neutropenia), johon liittyy kuume ja infektio
- sinulla esiintyy verihiutaleiden vähenemistä. Saat tavallista helpommin verenvuotoja ja mustelmia
- sinulla on tai on joskus ollut maksavaurio (maksasairaus), mukaan lukien poikkeavia tuloksia maksan toimintakokeissa
- sinulla on tai on aikaisemmin ollut vaikeita iho-oireita nimeltään Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi tai lääkkeeseen liittyvä yleisoireinen eosinofiilinen reaktio (tunnetaan myös nimillä DRESS tai lääkeyliherkkyysoireyhtymä). (Ks. oireiden kuvaukset kohdasta Mahdolliset haittavaikutukset).
- sinulla on esiintynyt allerginen reaktio Thalidomide BMS ‑valmistetta otettuasi, esim. ihottumaa, kutinaa, turvotusta, huimausta tai hengitysvaikeuksia
- sinulla on ollut uneliaisuutta
- sinulla on esiintynyt kuumetta, vilunväristyksiä ja voimakasta vapinaa, johon on mahdollisesti liittynyt komplikaatioina matala verenpaine ja sekavuutta (nämä saattavat olla vaikea-asteisten infektioiden oireita)
- sinulla on tai on joskus ollut virusinfektio, erityisesti vyöruusu, B hepatiitti-infektio tai HIV. Jos olet epävarma, keskustele lääkärin kanssa. Thalidomide BMS -hoito voi aiheuttaa viruksen aktivoitumisen uudelleen sitä kantavilla potilailla, mistä seuraa infektion uusiutuminen. Lääkärin pitää tarkistaa, onko sinulla joskus ollut B hepatiitti-infektio.
- sinulla on munuais- tai maksavaivoja (ks. myös kohta Mahdolliset haittavaikutukset).
Kilpirauhasesi toiminta saatetaan tarkistaa ennen kuin käytät talidomidia, ja toimintaa saatetaan seurata hoidon aikana.
Kerro lääkärille tai hoitajalle heti, jos hoidon aikana tai sen jälkeen ilmenee jotakin seuraavista: näön hämärtyminen, näönmenetys tai kahtena näkeminen, puhevaikeudet, heikkous käsivarressa tai jalassa, muutokset kävelytavassa tai tasapaino-ongelmat, jatkuva puutuminen, tuntoaistin heikkeneminen tai häviäminen, muistinmenetys tai sekavuus. Nämä kaikki voivat olla oireita vakavasta ja mahdollisesti kuolemaan johtavasta aivosairaudesta, jonka nimi on progressiivinen multifokaalinen leukoenkefalopatia (PML). Jos sinulla on ollut näitä oireita ennen Thalidomide BMS -hoitoa, kerro lääkärille, jos oireissa tapahtuu muutoksia.
Lääkäri saattaa tarkistaa, onko sinulla kasvaimia runsaasti koko elimistössäsi, myös luuytimessä. Tämä voi aiheuttaa tilan, jossa kasvaimet hajoavat ja niistä vapautuu elimistöön poikkeavia kemiallisten aineiden pitoisuuksia, mikä voi johtaa munuaisten vajaatoimintaan (tätä sairautta kutsutaan nimellä tuumorilyysioireyhtymä) (ks. myös kohta Mahdolliset haittavaikutukset).
Lääkärin on arvioitava, kehittyykö sinulle muita pahanlaatuisia veritauteja (joita kutsutaan nimillä akuutti myelooinen leukemia ja myelodysplastiset oireyhtymät) Thalidomide BMS -hoidon aikana (ks. myös kohta Mahdolliset haittavaikutukset).
Verenluovutus on kielletty Thalidomide BMS -hoidon aikana ja vähintään 7 päivän ajan hoidon päättymisen jälkeen.
Jos et ole varma koskeeko mikään edellä mainituista sinua, keskustele lääkärin kanssa ennen kuin otat Thalidomide BMS -valmistetta.
Lapset ja nuoret
Thalidomide BMS ‑valmistetta ei suositella lapsille eikä alle 18‑vuotiaille nuorille.
Muut lääkevalmisteet ja Thalidomide BMS
Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan otat tai olet äskettäin ottanut muita lääkkeitä. Tämä käsittää myös ilman reseptiä saatavat lääkkeet mukaan lukien rohdosvalmisteet.
Muista kertoa lääkärille, jos käytät lääkkeitä
- jotka aiheuttavat uneliaisuutta, koska talidomidi saattaa lisätä niiden vaikutusta. Tämä koskee myös rauhoittavia lääkkeitä (kuten anksiolyytit, unilääkkeet, psyykenlääkkeet, H1‑antihistamiinit, opiaattien johdannaiset ja barbituraatit)
- jotka hidastavat sydämen lyöntinopeutta (aiheuttavat bradykardiaa eli sydämen hidaslyöntisyyttä, esim. antikoliiniesteraasit ja beetasalpaajat)
- joita käytetään sydämen toimintahäiriöhin ja komplikaatioihin (esim. digoksiini) tai veren ohentamiseen (kuten varfariini).
- joiden käytön yhteydessä esiintyy neuropatiaa, kuten muut syöpälääkkeet
- joita käytetään raskauden ehkäisyyn.
Thalidomide BMS ruuan, juoman ja alkoholin kanssa
Älä juo alkoholia, kun käytät Thalidomide BMS ‑valmistetta. Alkoholi saattaa aiheuttaa väsymystä ja Thalidomide BMS voimistaa väsymystä entisestään.
Raskaus ja imetys
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
Raskaus
Talidomidi aiheuttaa vakavia sikiövaurioita tai sikiön kuoleman.
- Jopa yksi raskaana olevan naisen ottama kapseli voi aiheuttaa vakavia sikiövaurioita
- Näitä vaurioita voivat olla lyhyet käsivarret tai sääret, epämuodostuneet kädet tai jalat, silmä- tai korvavauriot sekä sisäelinvauriot
Thalidomide BMS ‑valmisteen ottaminen on kielletty, jos olet raskaana. Et myöskään saa tulla raskaaksi Thalidomide BMS ‑valmisteen käytön aikana.
Sinun täytyy käyttää yhtä tehokasta raskauden ehkäisymenetelmää, jos olet nainen, joka saattaa tulla raskaaksi (ks. kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä).
Sinun täytyy lopettaa hoito ja kertoa lääkärillesi välittömästi, jos:
- tiedät tai luulet, että kuukautisesi ovat jääneet väliin, tai jos sinulla on poikkeavaa kuukautisvuotoa tai epäilet olevasi raskaana
- olet heteroseksuaalisessa sukupuoliyhteydessä ilman tehokasta ehkäisymenetelmää
Jos tulet raskaaksi talidomidihoidon aikana, sinun on keskeytettävä hoito ja ilmoitettava siitä lääkärillesi välittömästi.
Thalidomide BMS ‑valmistetta käyttävät miehet, joilla on naispuolinen partneri, joka voi tulla raskaaksi, katso kohtaa 2 ”Mitä sinun on tiedettävä, ennen kuin otat Thalidomide BMS ‑valmistetta”. Jos kumppanisi tulee raskaaksi, kun käytät talidomidia, sinun on ilmoitettava siitä lääkärillesi välittömästi.
Imetys
Älä imetä, kun käytät Thalidomide BMS ‑valmistetta, koska sen erittymisestä äidinmaitoon ei ole tietoja.
Ajaminen ja koneiden käyttö
Älä aja tai käytä mitään työvälineitä tai koneita, jos havaitset sivuvaikutuksia, kuten huimausta, väsymystä, uneliaisuutta tai näön hämärtymistä.
Miten valmistetta käytetään
Ota Thalidomide BMS ‑valmistetta juuri siten kuin lääkäri on määrännyt tai apteekkihenkilökunta on neuvonut. Tarkista ohjeet lääkäriltä tai apteekista, jos olet epävarma.
Kuinka paljon lääkettä otetaan
Suositeltu annos on 200 mg (4 x 50 mg kapseli) päivässä enintään 75‑vuotiaille aikuisille tai 100 mg (2 x 50 mg kapseli) päivässä yli 75‑vuotiaille aikuisille. Lääkärisi kuitenkin valitsee sinulle annoksen, seuraa edistystäsi ja saattaa säätää annostasi. Lääkärisi kertoo sinulle, kuinka Thalidomide BMS ‑valmistetta otetaan ja kuinka kauan sinun tarvitsee käyttää sitä (ks. Kohta Mitä sinun on tiedettävä ennen valmisteen käyttöä).
Thalidomide BMS ‑valmistetta käytetään päivittäin lääkekuureina, joista jokainen kestää kuusi viikkoa, yhdessä melfalaanin ja prednisonin kanssa, joita otetaan päivinä 1‑4 jokaisessa kuuden viikon kuurissa.
Tämän lääkkeen ottaminen
- Älä riko, avaa äläkä pureskele kapseleita. Jos rikkoutuneesta Thalidomide BMS ‑kapselista pääsee jauhetta iholle, pese iho heti huolellisesti saippualla ja vedellä.
- Terveydenhuollon ammattilaisten, huoltajien ja perheenjäsenten on käytettävä kertakäyttökäsineitä käsitellessään läpipainolevyjä tai kapseleita. Käsineet on sen jälkeen riisuttava varovasti ihoaltistuksen välttämiseksi, laitettava suljettavaan polyeteenimuovipussiin ja hävitettävä paikallisten vaatimusten mukaisesti. Kädet on sen jälkeen pestävä huolellisesti vedellä ja saippualla. Naisten, jotka ovat raskaana tai epäilevät olevansa raskaana, ei pidä käsitellä läpipainolevyjä tai kapseleita.
- Ota tämä lääke suun kautta
- Niele kapselit kokonaisena vesilasillisen kera
- Älä murskaa äläkä pureskele
- Ota kapselit kerta-annoksena juuri ennen nukkumaanmenoa. Tämä vähentää uneliaisuutta muina vuorokauden aikoina.
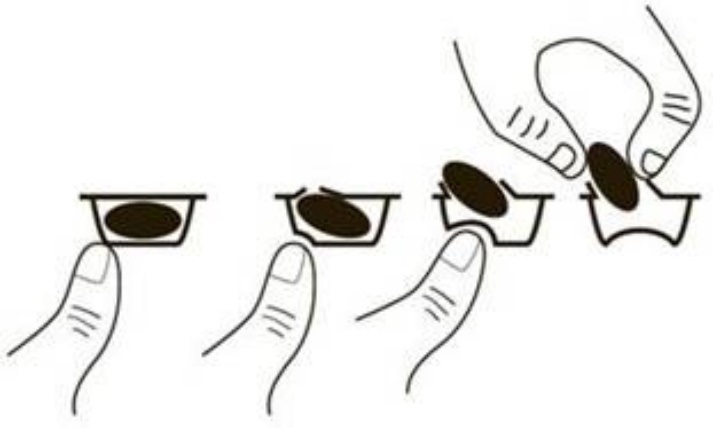
Kapselin poistamiseksi läpipainopakkauksesta paina vain toisesta päästä kapselia ja työnnä se folion läpi. Älä paina kapselin keskeltä, sillä se voi silloin rikkoutua.
Jos otat enemmän Thalidomide BMS ‑valmistetta kuin sinun pitäisi
Jos otat Thalidomide BMS ‑valmistetta enemmän kuin sinun pitäisi, keskustele lääkärisi kanssa tai mene välittömästi sairaalaan. Mikäli mahdollista, ota lääkepakkaus ja tämä pakkausseloste mukaasi.
Jos unohdat ottaa Thalidomide BMS ‑valmistetta
Jos unohdat ottaa Thalidomide BMS ‑valmisteen tavanomaiseen aikaan ja tästä on kulunut
- alle 12 tuntia: ota kapselit välittömästi.
- yli 12 tuntia: älä ota kapseleita. Ota seuraavat kapselit tavalliseen aikaan seuraavana päivänä.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin, apteekkihenkilökunnan tai sairaanhoitajan puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Tämä lääke saattaa aiheuttaa seuraavia haittavaikutuksia:
Lopeta Thalidomide BMS ‑valmisteen käyttö ja mene välittömästi lääkäriin, jos huomaat seuraavia vakavia haittavaikutuksia. Saatat tarvita pikaista lääkärinhoitoa:
- Erittäin voimakkaat ja vakavat ihoreaktiot. Ihohaittavaikutuksena voi esiintyä ihottumaa, joka voi olla rakkulaista. Ihoärsytys, haavaumat tai turvotus suussa, nielussa, silmien ympärillä, nenässä ja sukuelinten ympärillä sekä nesteturvotus, kuume ja influenssan kaltaiset oireet saattavat olla merkkejä Stevens‑Johnsonin oireyhtymästä, toksisesta epidermaalisesta nekrolyysistä tai lääkkeeseen liittyvästä yleisoireisesta eosinofiilisestä reaktiosta (DRESS), jotka ovat harvinaisista, vakavia ihoreaktioita.
- Allergiset reaktiot kuten paikallinen tai yleistynyt kutiava ihottuma, angioedeema ja anafylaktinen reaktio (vakavat allergiset reaktiot, joiden oireita voivat olla nokkosihottuma, ihottuma, silmien, suun tai kasvojen turvotus, hengitysvaikeudet tai kutina).
Kerro lääkärille välittömästi, jos huomaat seuraavia vakavia haittavaikutuksia:
- Tunnottomuutta, pistelyä, epänormaalia koordinaatiota tai kipua käsissä tai jaloissa.
Tämä saattaa johtua hermovauriosta (perifeerinen neuropatia), joka on hyvin yleinen haittavaikutus. Se voi muodostua hyvin vakavaksi, kivuliaaksi ja invalidisoivaksi. Jos koet tällaisia oireita, ota heti yhteys lääkäriisi, joka voi pienentää annosta tai keskeyttää hoidon. Tämä haittavaikutus ilmaantuu yleensä kun lääkettä on käytetty useita kuukausia, mutta se voi ilmaantua myös aikaisemmin. Se voi ilmaantua myös jonkin aikaa sen jälkeen kun hoito on lopetettu. Saattaa olla, että se ei häviä tai häviää hitaasti.
- Yhtäkkistä kipua rinnassa tai hengitysvaikeuksia.
Tämä saattaa johtua keuhkoihin johtavissa valtimoissa olevista veritulpista (keuhkoveritulppa), joka on yleinen haittavaikutus. Näitä voi esiintyä hoidon aikana tai hoidon lopettamisen jälkeen
- Kipua tai turvotusta säärissä, etenkin säären alaosassa tai pohkeissa.
Tämä saattaa johtua sääreen johtavissa laskimoissa olevista veritulpista (syvä laskimotukos), joka on yleinen haittavaikutus. Näitä voi esiintyä hoidon aikana tai hoidon lopettamisen jälkeen
- Rintakipua, joka leviää käsivarsiin, kaulaan, leukaan, selkään tai mahaan, hikoilun ja hengästyneisyyden tunne, huonovointisuus tai oksentelu.
Nämä saattavat olla sydänkohtauksen/sydäninfarktin oireita (jotka saattavat johtua sydämessä olevasta valtimoveritulpasta).
- Näkö- tai puhevaikeudet, jotka eivät kestä pitkään.
Nämä saattavat olla aivohalvauksen oireita (jotka saattavat johtua aivovaltimossa olevasta tukoksesta).
- Kuumetta, vilunväreitä, kurkkukipua, yskää, suun haavaumia tai muita infektion oireita.
- Verenvuotoa tai mustelmia ilman vammaa.
Muita haittavaikutuksia ovat mm:
On tärkeää huomata, että pienelle joukolle multippelia myeloomaa sairastavista potilaista voi kehittyä jokin toisentyyppinen syöpä, erityisesti pahanlaatuinen veritauti, ja että tämä riski saattaa Thalidomide BMS ‑hoidon yhteydessä olla suurentunut. Siksi lääkärisi tulee huolellisesti arvioida hyöty ja riski, kun hän määrää sinulle Thalidomide BMS ‑valmistetta.
Hyvin yleinen (saattaa esiintyä useammalla kuin yhdellä potilaalla 10:stä)
- ummetus
- huimaus
- uneliaisuus, väsymys
- vapina
- tuntoaistin heikentyminen tai poikkeavat tuntemukset (dysestesia)
- käsien ja jalkojen turvotus
- alhainen verisolujen määrä. Tämä voi viitata siihen, että sinulla on tavallista suurempi taipumus saada infektioita. Lääkärisi saattaa seurata verisolujesi määrää Thalidomide BMS ‑hoidon aikana.
Yleinen (saattaa esiintyä enintään yhdellä potilaalla 10:stä)
- ruuansulatushäiriöt, pahoinvointi, oksentaminen, suun kuivuminen
- ihottuma, ihon kuivuminen
- veren valkosolujen väheneminen (neutropenia), johon liittyy kuume ja infektio
- veren puna- ja valkosolujen sekä verihiutaleiden väheneminen samanaikaisesti (pansytopenia)
- voimattomuus, pyörrytys tai tasapainovaikeudet, energian tai voiman puute, alhainen verenpaine
- kuume, yleinen huonovointisuus
- kouristukset
- huimaava tunne päässä, mikä vaikeuttaa seisomista ja normaalia liikkumista
- näön hämärtyminen
- hengitysteiden infektio (keuhkokuume), keuhkotauti
- hidas syke, sydämen vajaatoiminta
- masennus, sekavuus, mielialan vaihtelut, ahdistus
- kuulon heikkeneminen tai kuurous
- munuaissairaus (munuaisten vajaatoiminta).
Melko harvinainen (saattaa esiintyä enintään yhdellä potilaalla 100:sta)
- keuhkoputkien tulehdus tai turvotus (bronkiitti)
- vatsanpeitteiden solujen tulehdus
- paksusuolessa oleva aukko, joka voi aiheuttaa tulehduksen
- paksusuolen tukos
- verenpaineen lasku seisomaan noustessa, mikä voi aiheuttaa pyörtymisen
- epäsäännölliset sydämen lyönnit (sydämen johtumishäiriö tai eteisvärinä), pyörrytyksen tunne tai pyörtyminen.
Tuntematon (koska saatavissa oleva tieto ei riitä arviointiin)
- kilpirauhasen vajaatoiminta (hypotyreoosi)
- seksuaalinen toimintahäiriö, esim. impotenssi
- vaikea verenmyrkytys (sepsis), johon liittyy kuumetta, vilunväreitä ja vaikeaa vapinaa, ja jonka mahdollisia komplikaatioita ovat alentunut verenpaine ja sekavuus (septinen sokki)
- tuumorilyysioireyhtymä – mahdollisesti syövän hoidon aikana ja joskus jopa ilman hoitoa esiintyvät metaboliset komplikaatiot. Nämä komplikaatiot ovat kuolevien syöpäsolujen hajoamistuotteiden aiheuttamia ja niitä voivat olla: veren kemian muutokset, kaliumin, fosforin ja virtsahapon korkeat tasot sekä kalsiumin alhainen taso, mistä ovat seurauksena munuaistoiminnan ja sydämen lyöntien muutokset, kouristukset ja joskus kuolema.
- maksavaurio (maksasairaus), mukaan lukien poikkeavat maksantoimintakokeiden tulokset
- mahan tai suoliston verenvuoto (maha‑suolikanavan verenvuoto)
- Parkinsonin taudin oireiden paheneminen (kuten vapina, masennus tai sekavuus)
- ylävatsa- ja/tai selkäkipu, joka saattaa olla vaikea ja joka jatkuu muutaman päivän ajan, ja johon mahdollisesti liittyy pahoinvointia, oksentelua, kuumetta ja nopeaa sykettä – nämä oireet saattavat johtua haimatulehduksesta (pankreatiitti)
- verenpaineen nousu keuhkoihin verta vievissä verisuonissa, mikä voi aiheuttaa hengenahdistusta, väsymystä, huimausta, rintakipua, sydämen sykkeen nopeutumista tai säärien tai nilkkojen turvotusta (keuhkoverenpainetauti)
- virusinfektiot, mukaan lukien vyöruusu (virussairaus, joka aiheuttaa kivuliasta ihottumaa ja rakkuloita) ja B‑hepatiitti-infektion uusiutuminen (joka voi aiheuttaa ihon ja silmien keltaisuutta, virtsan muuttumisen tummanruskeaksi, oikeanpuoleista vatsakipua, kuumetta ja pahoinvointia tai oksentelua).
- aivosairaus, johon liittyy näköhäiriöiden, päänsäryn, kouristuskohtausten ja sekavuuden kaltaisia oireita ja mahdollisesti myös verenpaineen nousua (posteriorinen reversiibeli enkefalopatiaoireyhtymä eli PRES).
- ihosairaus, joka johtuu pienten verisuonten tulehduksesta ja johon liittyy myös nivelkipua ja kuumetta (leukosytoklastinen vaskuliitti).
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille, apteekkihenkilökunnalle tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja
kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä lääkettä taitettavassa levyssä ja läpipainopakkauksessa mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Älä käytä tätä lääkettä, jos huomaat pakkauksen vaurioituneen tai siinä on avaamiseen viittaavia merkkejä.
Tämä lääke ei vaadi erityisiä säilytysolosuhteita.
Kaikki käyttämättömät lääkkeet pitää palauttaa apteekkiin tai lääkärille hoidon päätyttyä. Näillä toimenpiteillä estetään väärinkäyttö.
Pakkauksen sisältö ja muuta tietoa
Mitä Thalidomide BMS sisältää
- Vaikuttava aine on talidomidi. Jokainen kapseli sisältää 50 mg talidomidia.
- Muut apuaineet ovat:
- Kapselin sisältö sisältää esigelatinoitua tärkkelystä ja magnesiumstearaattia.
- Kapselin kuori sisältää gelatiinia ja titaanioksidia (E171).
- Painomuste sisältää sellakkaa, mustaa rautaoksidia (E172) ja propyleeniglykolia.
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Thalidomide BMS ‑kapselit ovat valkoisia ja kovia, joissa on merkintä ”Thalidomide BMS 50 mg”. Kapselit ovat taitettavassa levyssä, jossa on 28 kapselia (2 läpipainolevyä, joissa kummassakin on 14 kapselia).
Myyntiluvan haltija
Bristol‑Myers Squibb Pharma EEIG
Plaza 254
Blanchardstown Corporate Park 2
Dublin 15, D15 T867
Irlanti
Valmistaja
Celgene Distribution B.V.
Orteliuslaan 1000
3528 BD Utrecht
Alankomaat
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Oy Bristol-Myers Squibb (Finland) Ab
Puh/Tel: + 358 9 251 21 230
medinfo.finland@bms.com
Tämä pakkausseloste on tarkistettu viimeksi 01.2025.
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivulla http://www.ema.europa.eu /. Siellä on myös linkkejä muille harvinaisten sairauksien ja harvinaislääkkeiden www-sivuille.