Pakkausseloste
BERINERT injektio/infuusiokuiva-aine ja liuotin, liuosta varten 500 IU
Berinert 500 IU, injektio/infuusiokuiva-aine ja liuotin, liuosta varten.
Ihmisen C1-esteraasi-inhibiittori
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin aloitat lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä tule antaa muiden käyttöön. Se voi aiheuttaa haittaa muille, vaikka heillä olisikin samanlaiset oireet kuin sinulla.
- Jos havaitset haittavaikutuksia, käänny lääkärin tai apteekkihenkilökunnan puoleen. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä Berinert on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät Berinert-valmistetta
- Miten Berinert-valmistetta käytetään
- Mahdolliset haittavaikutukset
- Berinert-valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Mitä Berinert on?
Berinert koostuu kuiva-aineesta ja liuottimesta. Niistä sekoitetaan liuos, joka annetaan ruiskeena tai infuusiona laskimoon.
Berinert on valmistettu ihmisen plasmasta (veren nestemäisestä osasta). Se sisältää vaikuttavana aineena proteiiniperäistä ihmisen C1-esteraasi-inhibiittoria.
Mihin Berinert-valmistetta käytetään?
Berinert-valmistetta käytetään tyypin I ja II hereditaarisen angioedeeman (HAE, perinnöllinen angioedeema) hoitoon (edeema tarkoittaa turpoamista) ja lääketieteellistä toimenpidettä edeltävään ennaltaehkäisyyn. HAE on synnynnäinen verisuonistosairaus. Se ei ole allergiasairaus. HAE johtuu tärkeän valkuaisaineen, C1-esteraasi-inhibiittorin, vajauksesta, puuttumisesta tai virheellisestä muodostumisesta elimistössä. Sairaudelle ovat luonteenomaisia seuraavat oireet:
- äkillisesti ilmaantuva käsien ja jalkaterien turpoaminen
- äkillisesti ilmaantuva kasvojen turpoaminen, johon liittyy kiristyksen tunnetta
- silmäluomien turpoaminen, huulten turpoaminen, mahdollisesti kurkunpään (äänihuulten) turpoaminen, johon liittyy hengitysvaikeuksia
- kielen turpoaminen
- vatsanseudun äkillinen, kova sisäelinkipu (koliikkikipu).
Sairaus voi kohdistua yleisesti ottaen mihin tahansa elimistön osaan.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Seuraavissa kohdissa on tietoa, joka lääkärin on huomioitava ennen kuin saat Berinert-hoitoa.
Älä käytä Berinert-valmistetta:
- jos olet allerginen proteiini C1-esteraasi-inhibiittorille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa).
Kerro lääkärille tai apteekissa, jos olet allerginen jollekin lääkkeelle tai ruoka-aineelle.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin käytät Berinert-valmistetta
- jos sinulla on aiemmin esiintynyt allergisia reaktioita Berinert-valmisteen käytön yhteydessä. Sinun on käytettävä estohoitona antihistamiineja ja kortikosteroideja, jos lääkäri on niin kehottanut.
- kun sinulla on allergisia tai anafylaksian kaltaisia reaktioita (vakava allerginen reaktio, joka aiheuttaa vaikeita hengitysvaikeuksia tai huimausta). Berinert-valmisteen antaminen on tällöin lopetettava heti (esim. infuusion anto on keskeytettävä).
- jos sinulla on kurkunpään turvotusta. Tilaasi on seurattava tarkoin ja ensiavun on oltava heti saatavilla.
- valmisteen käytössä muihin kuin hyväksyttyihin käyttöaiheisiin ja hyväksyttyinä annoksina (esim. kapillaarivuoto-oireyhtymä). Ks. kohta Mahdolliset haittavaikutukset.
Lääkäri punnitsee tarkoin Berinert-hoidon hyödyt näiden lisäsairauksien riskiin nähden.
Virusturvallisuus
Kun ihmisen verestä tai plasmasta valmistetaan lääkkeitä, infektioiden siirtymistä potilaisiin estetään tietyin toimenpitein. Tällaisia ovat:
- veren ja plasman luovuttajien tarkka valinta sen varmistamiseksi, että infektioita mahdollisesti kantavat henkilöt voidaan sulkea pois ja
- kaikesta luovutetusta verestä ja plasmasta sekä plasmapooleista tutkitaan viruksiin/infektioihin viittaavat merkit.
Tällaisten valmisteiden valmistajat ovat myös ottaneet veri- tai plasmavalmisteiden valmistuksessa käyttöön vaiheita, joissa virukset voidaan inaktivoida tai poistaa. Tällaisista toimenpiteistä huolimatta taudinaiheuttajien siirtymisen mahdollisuutta ei voida täysin sulkea pois, kun käytetään ihmisen verestä tai plasmasta valmistettuja lääkevalmisteita. Tämä koskee myös tuntemattomia tai vasta kehittymässä olevia viruksia tai muuntyyppisiä infektioita.
Käytössä olevien toimenpiteiden katsotaan tehoavan vaipallisiin viruksiin, kuten ihmisen immuunikatovirukseen (HIV, aids-virus), hepatiitti B -virukseen, hepatiitti C -virukseen (maksatulehdus) ja vaipattomiin viruksiin kuten hepatiitti A -virus (maksatulehdus) ja parvovirus B19.
Lääkäri saattaa suositella rokotuksen ottamista hepatiitti A:ta ja B:tä vastaan, jos saat säännöllisesti/toistuvasti ihmisen plasmasta valmistettuja lääkevalmisteita.
Antopäivä, valmisteen eränumero ja potilaalle annettu lääkemäärä kehotetaan kirjaamaan Berinert-valmisteen jokaisen antokerran yhteydessä.
Muut lääkevalmisteet ja Berinert
- Kerro lääkärille tai apteekkihenkilökunnalle, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
- Berinert-valmistetta ei saa sekoittaa muiden lääkevalmisteiden ja liuottimien kanssa samaan ruiskuun/infuusiolaitteeseen.
Raskaus ja imetys
- Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä tai apteekista neuvoa ennen tämän lääkkeen käyttöä.
- Berinert-valmistetta ei pitäisi käyttää raskauden ja imetyksen aikana, mikäli käyttö ei ole selvästi välttämätöntä.
Ajaminen ja koneiden käyttö
Tutkimuksia valmisteen vaikutuksista ajokykyyn tai koneiden käyttökykyyn ei ole tehty.
Berinert sisältää natriumia
Berinert sisältää enintään 49 mg natriumia (ruokasuolan toinen ainesosa) per injektiopullo. Tämä vastaa 2,5 %:a suositellusta natriumin enimmäisvuorokausiannoksesta aikuiselle.
Miten valmistetta käytetään
Hoito on aloitettava ja toteutettava C1-esteraasi-inhibiittorin puutoksen hoitoon perehtyneen lääkärin valvonnassa.
Annostus
Aikuiset
Akuuttien HAE-kohtausten hoito:
20 IU:ta painokiloa kohden (20 IU/kg).
Lääketieteellistä toimenpidettä edeltävä HAE-kohtausten ehkäisy:
1000 IU:ta korkeintaan 6 tuntia ennen lääkintä-, hammas- tai kirurgista toimenpidettä.
Lapset ja nuoret
Akuuttien HAE-kohtausten hoito:
20 IU:ta painokiloa kohden (20 IU/kg)
Lääketieteellistä toimenpidettä edeltävä HAE-kohtausten ehkäisy:
15−30 IU:ta painokiloa kohden (15−30 IU/kg) korkeintaan 6 tuntia ennen lääkintä-, hammas- tai kirurgista toimenpidettä. Annoksen valinnassa on huomioitava kliiniset olosuhteet (esim. toimenpiteen laatu ja sairauden vakavuus).
Jos käytät enemmän Berinert-valmistetta kuin sinun pitäisi
Yliannostustapauksia ei ole raportoitu. Jos olet saanut tai ottanut liian suuren lääkeannoksen tai vaikkapa lapsi on ottanut lääkettä vahingossa, ota aina yhteyttä lääkäriin, sairaalaan tai Myrkytystietokeskukseen (puh. 112 Ruotsissa, 0800 147111 Suomessa) riskien arvioimiseksi ja lisäohjeiden saamiseksi.
Käyttövalmiiksi saattaminen ja antotapa
Berinertin laskimonsisäisen injektoinnin tekee yleensä lääkäri tai sairaanhoitaja. Sinä tai avustajasi voitte myös injektoida Berinertin, mutta vain riittävän opastuksen jälkeen. Jos lääkärisi päättää, että kotihoito voi soveltua sinulle, hän antaa sinulle yksityiskohtaiset ohjeet. Sinun täytyy myös kirjata jokainen kotona annettu hoitoannos päiväkirjaan, jonka otat mukaan lääkärikäynneille. Sinun tai avustajasi injektiotekniikka tarkistetaan säännöllisesti jatkuvan oikean käsittelyn varmistamiseksi.
Yleiset ohjeet
- Kuiva-aine on sekoitettava ja vedettävä injektiopullosta ruiskuun aseptisissa olosuhteissa. Käytä tuotteen mukana toimitettua ruiskua.
- Käyttövalmiiksi sekoitetun liuoksen on oltava väritöntä ja kirkasta. Liuos on tarkistettava suodattamisen tai ruiskuun vetämisen (ks. seuraavassa) jälkeen silmämääräisesti ennen antoa, ettei siinä ole havaittavissa hiukkasia eikä värinmuutoksia.
- Älä käytä liuosta, jos se on sameaa tai siinä on sakkaa.
- Käyttämätön valmiste ja jäte on hävitettävä paikallisten vaatimusten ja lääkärin antamien ohjeiden mukaisesti.
Käyttövalmiiksi saattaminen
Anna Berinert-kuiva-aineen ja liuottimen lämmetä huoneenlämpöiseksi avaamatta kumpaakaan injektiopulloa. Tämä voidaan tehdä joko antamalla injektiopullojen olla huoneenlämmössä noin tunnin ajan tai pitämällä niitä kädessä muutaman minuutin ajan. ÄLÄ altista injektiopulloja suoralle lämmölle. Injektiopulloja ei saa lämmittää ruumiinlämpötilaa (37 °C) korkeammassa lämpötilassa.
Posta suojakorkki varovasti liuottimen ja kuiva-aineen sisältävästä injektiopullosta. Puhdista kummankin injektiopullon esiin tullut kumitulppa alkoholipyyhkeellä (kumpikin eri pyyhkeellä) ja anna tulppien kuivua. Liuotin voidaan nyt siirtää kuiva-aineen sisältävään injektiopulloon kiinnitettävän antolaitteen (Mix2Vial) avulla. Noudata seuraavia ohjeita.
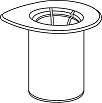
1. Avaa Mix2Vial-pakkaus vetämällä suojakansi pois. Älä ota Mix2Vial-laitetta pois pakkauksesta!
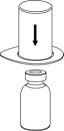
2. Aseta liuottimen sisältävä injektiopullo tasaiselle, puhtaalle alustalle ja ota injektiopullosta tukeva ote. Ota Mix2Vial sekä pakkaus ja paina sinisen sovittimen piikki suoraan liuotinpullon tulpan läpi.

3. Poista pakkaus varovasti Mix2Vial-laitteesta siten, että pidät pakkauksen reunasta kiinni ja vedät kohtisuoraan ylöspäin. Varmista, että vedät pois vain pakkauksen etkä Mix2Vial-laitetta.
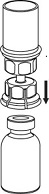
4. Aseta injektiopullo tasaiselle ja tukevalle alustalle. Käännä liuotinpullo ja siihen kiinnitetty Mix2Vial ylösalaisin, ja paina läpinäkyvän sovittimen piikki suoraan kuiva-aineinjektiopullon tulpan läpi. Liuotin siirtyy automaattisesti kuiva-aineen sisältävään injektiopulloon.

5. Ota toisella kädellä kiinni Mix2Vial-laitteen kuiva-aineen sisältävän injektiopullon puolelta ja toisella kädellä liuottimen sisältävän injektiopullon puolelta ja kierrä laite varovasti kahteen osaan.
Hävitä liuotinpullo ja siihen kiinnitetty sininen Mix2Vial-sovitin.

6. Pyörittele kuiva-aineinjektiopulloa ja siihen kiinnitettyä läpinäkyvää sovitinta, kunnes kuiva-aine on liuennut täysin. Ei saa ravistaa.
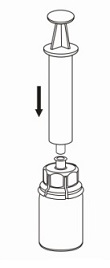
7. Vedä tyhjään, steriiliin ruiskuun ilmaa. Käytä tuotteen mukana toimitettua ruiskua. Kun kuiva-aineen sisältävä injektiopullo on oikeinpäin, kiinnitä ruisku Mix2Vial-sovittimen Luer Lock -liittimeen. Ruiskuta ilma kuiva-aineen sisältävään injektiopulloon.
Valmisteen vetäminen ruiskuun ja anto
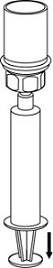
8. Kun ruiskun mäntä on alas painettuna, käännä laite ja injektiopullo ylösalaisin ja vedä liuos ruiskuun vetämällä mäntää hitaasti ulospäin.
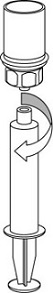
9. Kun liuos on nyt siirretty ruiskuun, ota tukeva ote ruiskun kammiosta (pitäen ruiskun mäntää samalla alaspäin) ja irrota ruiskusta läpinäkyvä Mix2Vial-sovitin.
Antotapa
Liuos annetaan hitaana injektiona tai infuusiona (4 ml/minuutti) laskimoon.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Ota heti yhteyttä lääkäriin
- jos sinulle ilmaantuu jokin haittavaikutus tai
- jos havaitset jonkin haittavaikutuksen, jota ei ole mainittu tässä pakkausselosteessa.
Haittavaikutukset ovat Berinert-hoidon yhteydessä harvinaisia.
Seuraavia haittavaikutuksia on havaittu harvoin (yhdellä tai useammalla potilaalla 10 000:sta, mutta harvemmalla kuin yhdellä potilaalla 1 000:sta):
- Verihyytymien muodostumisen vaara on suurentunut, kun valmistetta on käytetty tarkoituksena antaa estohoitoa tai hoitoa kapillaarivuoto-oireyhtymään (nesteen tihkuminen pienistä verisuonista kudoksiin), esim. sydänleikkausten aikana tai jälkeen, kun leikkauksessa on käytetty kehonulkoista verenkiertoa. Ks. kohta Varoitukset ja varotoimet.
- Ruumiinlämmön kohoamista sekä kirvelyä ja pistelyä pistoskohdassa.
- Yliherkkyys- tai allergisia reaktioita (esim. sydämensykkeen epäsäännöllisyyttä, sydämensykkeen kiihtymistä, verenpaineen alenemista, ihon punoitusta, ihottumaa, hengitysvaikeuksia, päänsärkyä, huimausta, oksentelua).
Hyvin harvinaisissa tapauksissa (harvemmalla kuin yhdellä potilaalla 10 000:sta tai yksittäistapauksissa) yliherkkyysreaktiot voivat kehittyä sokiksi.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan:
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
Valmisteen säilyttäminen
- Ei lasten ulottuville eikä näkyville.
- Älä käytä tätä lääkettä etiketissä ja ulkopakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
- Säilytä alle 30 °C.
- Ei saa jäätyä.
- Pidä injektiopullo ulkopakkauksessa. Herkkä valolle.
- Berinert ei sisällä säilytysainetta, joten valmiiksi sekoitettu injektioneste on mieluiten käytettävä heti.
- Jos käyttövalmiiksi sekoitettua injektionestettä ei anneta heti, se on käytettävä 8 tunnin kuluessa ja säilytettävä injektiopullossa.
Pakkauksen sisältö ja muuta tietoa
Mitä Berinert sisältää
Vaikuttava aine on:
Ihmisen C1-esteraasi-inhibiittori (500 IU:ta injektiopullossa, käyttövalmiiksi sekoitetussa liuoksessa 50 IU:ta/ml).
Ks. lisätietoja kohdasta "Seuraavat tiedot on tarkoitettu vain hoitoalan ammattilaisille."
Muut aineet ovat:
Glysiini, natriumkloridi, natriumsitraatti
Ks. viimeinen kappale kohdasta Mitä sinun on tiedettävä ennen valmisteen käyttöä. "Berinert sisältää natriumia."
Liuotin: Injektionesteisiin käytettävä vesi
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Berinert on valkoinen kuiva-aine, jonka lisäksi pakkaus sisältää injektionesteisiin käytettävää vettä liuottimena käytettäväksi.
Käyttövalmiiksi sekoitetun liuoksen on oltava väritöntä ja kirkasta.
Pakkaus
500 IU:n ulkopakkaus sisältää:
yhden kuiva-aineen sisältävän injektiopullon (500 IU)
yhden 10 ml injektionesteisiin käytettävää vettä sisältävän injektiopullon
yhden suodattimella varustetun siirtolaitteen 20/20
Annostelutarvikkeet (sisälaatikko) sisältävät:
yhden kertakäyttöisen 10 ml:n ruiskun
yhden laskimopunktiolaitteen
kaksi alkoholipyyhettä
yhden laastarin.
Myyntiluvan haltija ja valmistaja
CSL Behring GmbH
Emil-von-Behring-Strasse 76
35041 Marburg
Saksa
Lisätietoa tästä valmisteesta antaa myyntiluvan haltijan edustaja:
CSL Behring AB
Box 712
182 17 Danderyd
Ruotsi
Tällä lääkevalmisteella on myyntilupa Euroopan talousalueeseen kuuluvissa jäsenvaltioissa seuraavilla kauppanimillä:
Berinert 500: Belgia, Kreikka, Kypros, Luxemburg, Puola, Saksa
Berinert 500, 500 IU Powder and solvent for solution for injection/infusion: Bulgaria
Berinert 500 UI Polvo para solución inyectable y para perfusión: Espanja
Berinert: Italia, Tanska, Portugali
Berinert 500 IE Pulver und Lösungsmittel zur Herstellung einer Injektions- oder Infusionslösung: Itävalta
Berinert 500 IU pulver og væske til injeksjons-/infusjonsvæske, oppløsning: Norja
Berinert 500 UI, poudre et solvant pour solution injectable/perfusion: Ranska
Berinert 500 UI, pulbere şi solvent pentru soluţie injectabilă/perfuzabilă: Romania
Berinert 500 IE, pulver och vätska till injektions-/infusionsvätska, lösning: Ruotsi
Berinert 500 IU: Slovakia, Tshekki
Berinert 500 i.e. prašek in vehikel za raztopino za injiciranje/infundiranje: Slovenia
Berinert 500 IU, injektio/infuusiokuiva-aine ja liuotin, liuosta varten: Suomi
Berinert 500 NE por és oldószer oldatos injekcióhoz vagy infúzióhoz: Unkari
Berinert 500 IE Pulver und Berinert 500 IU powder and solvent for solution for injection/infusion: Yhdistynyt Kuningaskunta
Tämä pakkausseloste on tarkistettu viimeksi: 11.10.2021
Ohjeet terveydenhuollon ammattilaiselle
VAIKUTTAVAT AINEET JA NIIDEN MÄÄRÄT
C1-esteraasi-inhibiittorien teho ilmaistaan WHO:n ihmisen C1-esteraasi-inhibiittoreita koskevan voimassa olevan standardin mukaisesti kansainvälisinä yksikköinä (International Units, IU).