Pakkausseloste
METROBACTIN VET tabletti 250 mg
ELÄINLÄÄKEVALMISTEEN NIMI
Metrobactin vet 250 mg tabletit koirille ja kissoille
metronidatsoli
VAIKUTTAVAT JA MUUT AINEET
1 tabletti sisältää:
Vaikuttava aine:
Metronidatsoli 250 mg
Vaaleanruskea, ruskeapilkullinen, pyöreä ja kupera maustettu tabletti, jonka toisella puolella on ristinmuotoinen jakouurre.
Tabletit voidaan jakaa kahteen tai neljään yhtä suureen osaan.
KÄYTTÖAIHEET
Giardia spp:n ja Clostridium spp:n (ts. C. perfringens tai C. difficile) aiheuttamien mahasuolikanavan infektioiden hoito.
Metronidatsolille herkkien obligatorisesti anaerobisten bakteerien (esim. Clostridium spp.) aiheuttamien virtsa- ja sukupuolielin-, suuontelo-, nielu- ja ihoinfektioiden hoito.
VASTA-AIHEET
Ei saa käyttää tapauksissa, joissa esiintyy maksan maksasairauksia.
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle tai apuaineille.
HAITTAVAIKUTUKSET
Metronidatsolin annon jälkeen saattaa ilmetä seuraavia haittavaikutuksia: oksentelu, maksatoksisuus, valkosolukato (neutropenia). Hyvin harvinaisissa tapauksissa voi ilmetä neurologisia oireita.
Haittavaikutusten esiintyvyys määritellään seuraavasti:
- hyvin yleinen (useampi kuin 1/10 hoidettua eläintä saa haittavaikutuksen)
- yleinen (useampi kuin 1 mutta alle 10 /100 hoidettua eläintä)
- melko harvinainen (useampi kuin 1 mutta alle 10 / 1000 hoidettua eläintä)
- harvinainen (useampi kuin 1 mutta alle 10 / 10.000 hoidettua eläintä)
- hyvin harvinainen (alle 1 / 10.000 hoidettua eläintä, mukaan lukien yksittäiset ilmoitukset).
Jos havaitset haittavaikutuksia, myös sellaisia joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä että lääke ei ole tehonnut, ilmoita asiasta eläinlääkärillesi
Vaihtoehtoisesti voit myös ilmoittaa kansallista raportointijärjestelmää käyttäen www.fimea.fi/elainlaakkeet/.
KOHDE-ELÄINLAJI
Koira ja kissa
ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Suun kautta.
Metronidatsolin suositeltu annos on 50 mg/kg/vrk 5−7 vuorokauden ajan. Vuorokausiannos voidaan jakaa kahteen yhtä suureen annokseen vuorokaudessa (ts. 25 mg/kg kahdesti vuorokaudessa).
Oikean annoksen antaminen edellyttää mahdollisimman tarkkaa painon määritystä.
ANNOSTUSOHJEET
Tabletit voidaan jakaa 2:een tai 4:ään yhtä suureen osaan tarkkaa annostelua varten. Aseta tabletti tasaiselle alustalle jakouurrepuoli ylöspäin ja kupera (pyöreä) puoli alaspäin.
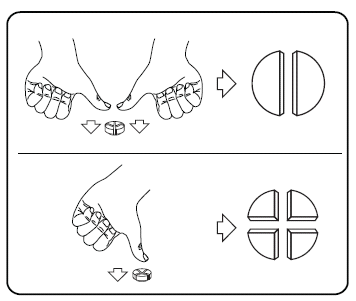
Puolikkaat: paina peukaloillasi tabletin molempia puolia.
Neljännekset: paina peukalollasi tabletin keskeltä.
VAROAIKA
Ei oleellinen
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville.
Jaettujen tablettien kestoaika: 3 vrk.
Ei erityisiä säilytysohjeita. Älä käytä tätä eläinlääkevalmistetta viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu pakkauksessa merkinnän EXP jälkeen.
Erääntymispäivällä tarkoitetaan kuukauden viimeistä päivää.
ERITYISVAROITUKSET
Eläimiä koskevat erityiset varotoimet
Koska metronidatsolille vastustuskykyisten bakteerien esiintymisessä on todennäköisesti (ajallisia, maantieteellisiä) vaihteluita, suositellaan bakteriologisen näytteen ottoa ja herkkyysmääritystä.
Mikäli mahdollista, valmistetta tulisi käyttää ainoastaan herkkyysmäärityksen perusteella.
Eläinlääkevalmisteen käytössä on noudatettava mikrobi lääkehoidon tarkoituksenmukaista käyttöä koskevia virallisia, kansallisia ja paikallisia ohjeita.
Tabletit ovat maustettuja. Säilytä tabletit eläinten ulottumattomissa tablettien tahattoman nielemisen välttämiseksi.
Hermostollisia oireita saattaa ilmetä erityisesti pitkäaikaisessa metronidatsolihoidossa.
Erityiset varotoimenpiteet, joita eläinlääkevalmistetta antavan henkilön on noudatettava
Metronidatsolilla on vahvistettu olevan mutaatioita aiheuttavia ja perimämyrkyllisiä ominaisuuksia sekä laboratorioeläimillä että ihmisillä. Metronidatsolin on vahvistettu olevan syöpää aiheuttava laboratorioeläimille, ja sillä saattaa olla syöpää aiheuttavia vaikutuksia ihmisille. Metronidatsolin kyvystä aiheuttaa syöpää ihmisille ei kuitenkaan ole riittävästi näyttöä.
Metronidatsoli voi vahingoittaa sikiötä.
Vältä valmisteen joutumista iholle tai limakalvoille, myös sen joutumista kädestä suuhun. Käytä näiden välttämiseksi läpäisemättömiä käsineitä valmistetta käsitellessäsi ja/tai antaessasi sitä suoraan eläimen suuhun.
Älä anna hoidetun koiran nuolla ketään heti lääkkeen annon jälkeen. Jos valmistetta joutuu iholle, pese ihoalue huolellisesti. Valmisteen tahattoman nielemisen välttämiseksi ja etenkin sen välttämiseksi, että lapsi nielee valmistetta, käyttämättömät tabletin osat pitää laittaa takaisin avattuun läpipainopakkaukseen, joka laitetaan takaisin ulkokoteloon ja säilytetään turvallisessa paikassa poissa lasten näkyviltä ja ulottuvilta. Käyttämättä jäävät tabletin osat pitää käyttää seuraavalla antokerralla.
Jos vahingossa nielet valmistetta, käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Pese kädet huolellisesti käytön jälkeen. Metronidatsoli voi aiheuttaa yliherkkyysreaktioita. Henkilöiden, jotka ovat yliherkkiä metronidatsolille, tulee välttää kosketusta eläinlääkevalmisteen kanssa.
Tiineys ja imetys
Laboratorioeläimillä tehtyjen tutkimusten tulokset ovat olleet ristiriitaisia metronidatsolin epämuodostumia aiheuttavien (teratogeenisten)/alkiotoksisten vaikutusten osalta. Sen vuoksi käyttöä ei suositella tiineyden aikana. Metronidatsoli erittyy maitoon, minkä vuoksi käyttöä ei suositella imetyksen aikana.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset
Metronidatsolilla saattaa olla muiden lääkkeiden, kuten fenytoiinin, siklosporiinin tai varfariinin, maksassa tapahtuvaa hajoamista estävä vaikutus.
Simetidiini saattaa hidastaa metronidatsolin metaboliaa maksassa, mikä suurentaa metronidatsolin pitoisuutta seerumissa.
Fenobarbitaali saattaa nopeuttaa metronidatsolin metaboliaa maksassa, mikä alentaa metronidatsolin pitoisuutta seerumissa.
Yliannostus (oireet, hätätoimenpiteet, vastalääkkeet)
Suositeltua suuremmat annokset ja pidempi hoito kesto lisäävät haittavaikutusten todennäköisyyttä. Hermostollisten oireiden ilmetessä hoito on keskeytettävä ja potilaalle on annettava oireenmukaista hoitoa.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Käyttämättömät eläinlääkevalmisteet tai niistä peräisin olevat jätemateriaalit on hävitettävä paikallisten määräysten mukaisesti.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
12.4.2022
MUUT TIEDOT
Alumiini-PVC/PE/PVDC-läpipainopakkaus
Kartonkipakkauksessa 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 25 tai 50 läpipainopakkausta, joissa kussakin 10 tablettia.
Kartonkipakkauksessa 10 pakkausta, joissa kussakin 1 tai 10 läpipainopakkausta, joissa kussakin 10 tablettia.
Kaikkia pakkauskokoja ei välttämättä ole markkinoilla.
 Jaettava tabletti
Jaettava tabletti
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija:
Dechra Regulatory B.V.
Handelsweg 25
5531 AE Bladel
Alankomaat
Erän vapauttamisesta vastaava valmistaja:
LelyPharma B.V.
Zuiveringsweg 42
8243 PZ Lelystad
Alankomaat
Genera Inc.
Svetonedeljska cesta 2, Kalinovica
10436 Rakov Potok
Kroatia
Painetussa pakkaussetelissä mainitaan ainoastaan tuotteen testauksen ja erien vapauttamisen sijaintipaikka.