Pakkausseloste
MULTIBIC KALIUM hemodialyysi- / hemofiltraationeste 2 mmol/l
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti, ennen kuin aloitat tämän lääkkeen käyttämisen, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai sairaanhoitajan puoleen.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
- Mitä multiBic 2 mmol/l kalium on ja mihin sitä käytetään
- Mitä sinun on tiedettävä, ennen kuin käytät multiBic 2 mmol/l kalium -valmistetta
- Miten multiBic 2 mmol/l kalium -valmistetta käytetään
- Mahdolliset haittavaikutukset
- multiBic 2 mmol/l kalium -valmisteen säilyttäminen
- Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
multiBic 2 mmol/l kalium on jatkuvan munuaiskorvaushoidon liuos, jota käytetään munuaisten vajaatoiminnassa. Sen avulla munuaispotilaan kehosta poistetaan kuona-aineita. Sitä käytetään myös munuaisvaurioiden ja myrkytysten hoidossa. Annettavan nesteen laatu riippuu veressä olevan kaliumin (suolan) määrästä. Lääkäri tarkistaa potilaan kaliumtasot säännöllisesti.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Älä käytä multiBic 2 mmol/l kalium -valmistetta
- jos olet allerginen vaikuttaville aineille tai tämän lääkkeen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa)
- jos sinulla on hypokalemia (alhainen kaliumtaso)
- jos sinulla on metabolinen alkaloosi (liian paljon bikarbonaattia veressä)
- jos on vaikeaa saada riittävästi verta virtaamaan hemofiltterin (verensuodattimen) läpi
- jos sinulla on suuri verenvuotoriski, koska veren hyytymistä estäviä lääkkeitä lisätään estämään hyytymistä hemofiltterissä.
Varoitukset ja varotoimet
Keskustele lääkärin kanssa ennen kuin käytät multiBic 2 mmol/l kalium -valmistetta.
- Valmistetta saa käyttää vasta sen jälkeen, kun kaksikammioisen pussin nesteet on sekoitettu.
- Valmistetta ei saa käyttää, jos liuoksen lämpötila on alle huoneenlämpötilan.
- Käyttövalmiin liuoksen antamisessa käytettävä letkusto on tarkistettava 30 minuutin välein. Jos letkustossa on sakkaa (kiinteää ainetta), pussi ja letkusto on heti vaihdettava ja potilaan tilaa on tarkkaan seurattava.
- Lääkäri tarkkailee nestetasapainoasi (veden määrää kehossasi), kalium- ja natriumtasojasi sekä muiden suolojen tasoja, tiettyjen kuona-aineiden määriä ja veresi sokeripitoisuuksia. Lääkäri voi myös antaa ruokavalio-ohjeita.
Lapset
multiBic 2 mmol/l kalium -valmisteen käyttöä lapsilla ei ole varmistettu.
Muut lääkevalmisteet ja multiBic 2 mmol/l kalium
Kerro lääkärille, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä.
Mahdollisia yhteisvaikutuksia:
- digitaliksen (sydänlääke) haitalliset vaikutukset
- elektrolyyttien korvaushoito, parenteraalinen (laskimoon annettava) ravinto ja muut infuusiohoidot, joiden vaikutukset veren seerumin pitoisuuksiin ja nestetilaan on otettava huomioon multiBic 2 mmol/l kalium -hoidossa
- multiBic 2 mmol/l kalium -hoito voi alentaa lääkkeiden pitoisuuksia veressä, ja annoksen muuttaminen saattaa olla tarpeen.
Raskaus ja imettäminen
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen tämän lääkkeen käyttöä.
Ei ole olemassa tietoja tai on vain vähän tietoja multiBic 2 mmol/l kalium -valmisteen käytöstä raskauden ja imetyksen aikana.
multiBic 2 mmol/l kalium -valmistetta saa käyttää raskauden aikana vain siinä tapauksessa, että lääkäri pitää hoitoa tarpeellisena.
Imetystä ei suositella multiBic 2 mmol/l kalium -hoidon aikana.
Miten valmistetta käytetään
multiBic 2 mmol/l kalium -hoito annetaan sairaalassa. Lääkäri tietää, miten tätä lääkettä käytetään.
Jos sinulla on kysymyksiä tämän lääkkeen käytöstä, käänny lääkärin puoleen.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin lääke voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
multiBic 2 mmol/l kalium -valmisteen haittavaikutuksia:
- pahoinvointi
- oksentelu
- lihaskouristukset
- verenpaineen muutokset.
Kehon liiallisen tai liian vähäisen nestemäärän aiheuttamia haittavaikutuksia:
- hengenahdistus
- nilkkojen ja jalkojen turvotus
- kuivuminen (esim. huimaus, lihaskouristukset, jano)
- veren poikkeavuudet (esim. veren epänormaalit suolakonsentraatiot).
Haittavaikutusten tarkka esiintymistiheys on tuntematon (koska saatavissa oleva tieto ei riitä arviointiin).
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai sairaanhoitajalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä säilytä alle 4 °C
Säilytys kammioiden sekoittamisen jälkeen:
Käyttövalmis liuos on säilytettävä alle 30 ºC:ssa ja se on käytettävä 48 tunnin kuluessa.
Älä käytä tätä lääkettä etiketissä mainitun viimeisen käyttöpäivämäärän (EXP) jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Pakkauksen sisältö ja muuta tietoa
Mitä multiBic 2 mmol/l kalium sisältää
- Vaikuttavat aineet ovat kaliumkoridi, natriumkloridi, natriumvetykarbonaatti, kalsiumklorididihydraatti, magnesiumkloridiheksahydraatti, glukoosimonohydraatti.
- Muut aineet ovat injektionesteisiin käytettävä vesi, kloorivetyhappo 25 %, hiilidioksidi ja natriumdivetyfosfaattidihydraatti.
Lääkevalmisteen kuvaus ja pakkauskoot
multiBic 2 mmol/l kalium -valmiste on kaksikammioisessa pussissa (kammioissa on erilaiset nesteet). Kammioiden nesteiden sekoittamisesta syntyy käyttövalmis liuos.
Pussissa on yhteensä 5000 ml nestettä. Käyttövalmis liuos on kirkas ja väritön.
Pussissa on HF-liitin, Luer-lock-liitin ja injektioportti sekä ulkokääre.
Pakkauskoko:
2 x 5000 ml:n pussi.
Myyntiluvan haltija ja valmistaja
Myyntiluvan haltija:
Fresenius Medical Care Deutschland GmbH, Else-Kröner-Straße 1, 61352 Bad Homburg v.d.H., Saksa
Valmistaja:
Fresenius Medical Care Deutschland GmbH, Frankfurter Straße 6-8, 66606 St. Wendel, Saksa
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Fresenius Medical Care Suomi Oy, puh.: +358 9 561 650
Tämä pakkausseloste on tarkistettu viimeksi 13.5.2025
Tietoa terveydenhuollon ammattilaisille tämän pakkausselosteen lopussa.
Ohjeet terveydenhuollon ammattilaiselle
1000 ml käyttövalmista liuosta sisältää:
| Kaliumkloridi | 0,1491 g |
| Natriumkloridi | 6,136 g |
| Natriumvetykarbonaatti | 2,940 g |
| Kalsiumklorididihydraatti | 0,2205 g |
| Magnesiumkloridiheksahydraatti | 0,1017 g |
| Glukoosimonohydraatti | 1,100 g |
| (Glukoosi) | (1,000 g) |
| K+ | 2,0 mmol/l |
| Na+ | 140 mmol/l |
| Ca2+ | 1,5 mmol/l |
| Mg2+ | 0,50 mmol/l |
| Cl- | 111 mmol/l |
| HCO3 - | 35 mmol/l |
| Glukoosi | 5,55 mmol/l |
pH≈7,4
Teoreettinen osmolariteetti: 296 mOsm/l
Valmistetta ei saa käyttää, jos käyttövalmis liuos ei ole kirkas ja väritön ja pussi ja liittimet ovat vahingoittuneet.
Vain kertakäyttöön. Käyttämättä jäänyt liuos on hävitettävä.
Käyttö vain kehonulkoisen verenpuhdistuslaitteen sisäänrakennetun pumpun avulla.
Käyttöohje
Hemodialyysi-/hemofiltraationeste annetaan kolmessa vaiheessa:
1. Ulkokääreen poistaminen ja hemofiltraatiopussin huolellinen tarkastaminen
Ulkokääre tulee poistaa vasta juuri ennen annostelua. Muoviset pakkaukset voivat joskus vaurioitua kuljetuksen tai säilytyksen aikana. Tämä saattaa aiheuttaa kontaminaation ja mikro-organismi- tai sienikasvustoa nesteissä. Kaikki pakkaukset täytyy siksi huolellisesti tarkastaa visuaalisesti vaurioiden varalta ennen pussin kytkemistä ja hemofiltraationesteen käyttöä. Myös pienet vauriot sulkijassa, saumassa ja pakkauksen kulmissa täytyy huomioida.
2. Kahden nestekammion yhdistäminen
Pussin kammioiden nesteet sekoitetaan juuri ennen käyttöä, jolloin saadaan käyttövalmis liuos.
A) B) C)
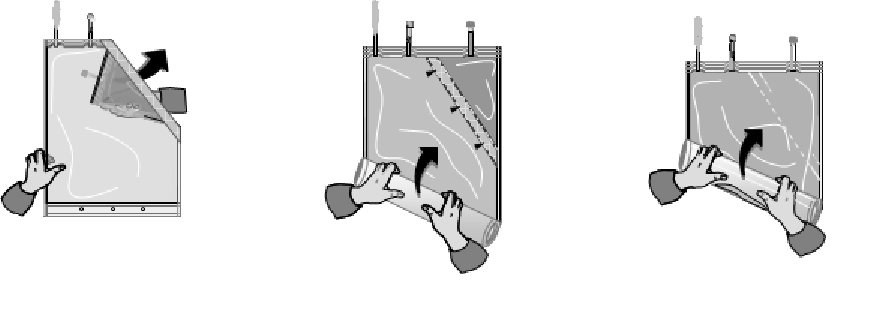



Tarkasta kammioiden sekoittamisen jälkeen, että ne erottanut sauma on täysin auki, että liuos on kirkas ja väritön ja että pakkaus ei vuoda.
3. Käyttövalmis liuos
Käyttövalmis liuos tulee käyttää välittömästi tai 48 tunnin kuluessa sekoittamisesta.
Käyttövalmiiseen liuokseen ei saa lisätä mitään, ennen kuin se on kauttaaltaan sekoittunut. Lisäyksen jälkeen liuos on jälleen sekoitettava kunnolla ennen käyttöä.
Natriumkloridiliuos (natriumkloridipitoisuus enintään 30 %) ja injektionesteisiin käytettävä vesi ovat yhteensopivia tämän lääkevalmisteen kanssa, ja niitä voidaan tarvittaessa käyttää tasaamaan natriumpitoisuuden muutosnopeutta vaikeissa hyper- tai hyponatremiatapauksissa.
Ellei muuta ole määrätty, käyttövalmis liuos tulisi lämmittää 36,5 °C - 38,0 °C:een juuri ennen infuusiota. Tarkka lämpötila tulee valita kliinisten vaatimusten ja käytetyn teknisen laitteiston mukaan