Pakkausseloste
CERVARIX injektioneste, suspensio, esitäytetty ruisku
Cervarix injektioneste, suspensio esitäytetyssä ruiskussa
Ihmisen papilloomavirusrokote (tyypit 16 ja 18) (rekombinantti, liitetty adjuvanttiin, adsorboitu)
Yleisiä ohjeita
Lue tämä pakkausseloste huolellisesti ennen kuin saat tätä rokotetta, sillä se sisältää sinulle tärkeitä tietoja.
- Säilytä tämä pakkausseloste. Voit tarvita sitä myöhemmin.
- Jos sinulla on kysyttävää, käänny lääkärin tai apteekkihenkilökunnan puoleen.
- Tämä lääke on määrätty vain sinulle eikä sitä pidä antaa muiden käyttöön.
- Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Ks. kohta Mahdolliset haittavaikutukset.
Tässä pakkausselosteessa kerrotaan
1. Mitä Cervarix on ja mihin sitä käytetään
2. Mitä sinun on tiedettävä, ennen kuin saat Cervarixia
3. Miten Cervarix annetaan
4. Mahdolliset haittavaikutukset
5. Cervarixin säilyttäminen
6. Pakkauksen sisältö ja muuta tietoa
Mitä valmiste on ja mihin sitä käytetään
Cervarix on rokote, joka on tarkoitettu suojaamaan 9 vuoden iästä alkaen ihmisen papilloomavirusten (HPV) aiheuttamilta taudeilta.
Näitä sairauksia ovat:
- kohdunkaulan syöpä (syöpä kohdunkaulassa eli kohdun alaosassa) ja peräaukon syöpä
- syövän esiasteiksi luettavat kohdunkaulan, ulkosynnyttimien, emättimen ja peräaukon muutokset (sukuelinten tai peräaukon solumuutokset, jotka voivat muuttua syöväksi).
Ihmisen papilloomavirustyypit (HPV) 16 ja 18, jotka sisältyvät rokotteeseen, aiheuttavat noin 70 % kaikista kohdunkaulan syövistä, 90 % peräaukon syövistä, 70 % HPV-tyyppeihin liittyvistä syövän esiasteiksi luettavista solumuutoksista ulkosynnyttimissä ja emättimessä ja 78 % HPV-tyyppeihin liittyvistä syövän esiasteiksi luettavista solumuutoksista peräaukossa. Myös muut HPV-tyypit voivat aiheuttaa anogenitaalialueen syöpiä. Cervarix ei suojaa kaikilta HPV-tyypeiltä.
Kun nainen tai mies rokotetaan Cervarixilla, immuunijärjestelmä (kehon oma puolustusjärjestelmä) alkaa tuottaa vasta-aineita HPV-tyyppejä 16 ja 18 vastaan.
Cervarix ei voi aiheuttaa infektiota, eikä se aikaansaa HPV-tauteja.
Cervarixia ei käytetä parantamaan rokotushetkellä jo olemassa olevia HPV-tauteja.
Cervarixia tulee käyttää virallisten suositusten mukaan.
Mitä sinun on tiedettävä ennen valmisteen käyttöä
Cervarixia ei saa antaa
- jos olet allerginen vaikuttaville aineille tai tämän rokotteen jollekin muulle aineelle (lueteltu kohdassa Pakkauksen sisältö ja muuta tietoa). Allergisen reaktion merkkejä voivat olla kutiava ihottuma, hengenahdistus ja kasvojen tai kielen turvotus.
Varoitukset ja varotoimet
Keskustele lääkärin tai apteekkihenkilökunnan kanssa ennen kuin saat Cervarixia,
- jos sinulla on verenvuoto-ongelmia tai saat helposti mustelmia
- jos sinulla on sairaus, joka vähentää vastustuskykyäsi infektioita vastaan, kuten HIV-infektio.
- jos sinulla on vaikea infektio, johon liittyy korkea kuume. Rokotusta on ehkä lykättävä, kunnes olet toipunut. Lievän infektion, kuten nuhakuumeen, ei pitäisi olla ongelma, mutta neuvottele ensin lääkärin kanssa.
Pyörtymistä voi esiintyä (enimmäkseen nuorilla) pistoksena annettavan rokotuksen jälkeen, tai jopa ennen. Kerro lääkärille tai sairaanhoitajalle, jos olet pyörtynyt tai lapsesi on pyörtynyt aikaisemman pistoksena annettavan rokotuksen yhteydessä.
Kuten muutkaan rokotteet Cervarix ei ehkä täysin suojaa kaikkia rokotettuja henkilöitä.
Cervarix ei suojaa henkilöitä HPV-16- tai HPV-18-infektion aiheuttamilta taudeilta, jos heillä jo rokotushetkellä on ihmisen papilloomaviruksen (HPV) tyyppien 16 tai 18 aiheuttama infektio.
Vaikka rokotus suojaisikin sinua kohdunkaulan syövältä, se ei korvaa säännöllisiä kohdunkaulan seulontatutkimuksia. Noudata edelleen lääkärin neuvoja kohdunkaulan irtosolututkimuksista/PAPA-näytteistä (tutkimuksissa voidaan löytää HPV-infektion aiheuttamia kohdunkaulan solumuutoksia) sekä ennaltaehkäisevistä ja suojaavista toimenpiteistä.
Koska Cervarix ei suojaa kaikkia ihmisen papilloomaviruksen (HPV) tyyppejä vastaan, asiallisia varotoimia HPV-tartunnan ja seksuaalisesti tarttuvien tautien välttämiseksi on jatkettava.
Cervarix ei suojaa taudeilta, jotka eivät ole HPV:n aiheuttamia.
Muut lääkevalmisteet ja Cervarix
Cervarix voidaan antaa samanaikaisesti kurkkumätä (d) -, jäykkäkouristus (T) - ja soluton hinkuyskä (ap) -tehosteyhdistelmärokotteen kanssa. Tehosteyhdistelmärokote voi myös sisältää inaktivoituja poliomyeliitti (IPV) -komponentteja (dTap- ja dTap-IPV-rokotteet). Cervarix voidaan myös antaa samanaikaisesti hepatiitti A- ja hepatiitti B-yhdistelmärokotteen kanssa (Twinrix), hepatiitti B- rokotteen kanssa (Engerix-B) tai meningokokki seroryhmien A, C, W-135, Y tetanustoksoidikonjugaattirokotteen (MenACWY-TT) kanssa. Jos Cervarix annetaan samanaikaisesti toisen injisoitavan rokotteen kanssa, rokotteet tulee aina antaa eri injektiokohtiin (kehon toiselle puolelle, esim. toiseen käsivarteen).
Cervarixin teho voi jäädä vaillinaiseksi, jos sitä käytetään samanaikaisesti immunosuppressiivisten lääkkeiden kanssa.
Kliinisissä tutkimuksissa suun kautta otettavat ehkäisyvalmisteet (esim. e-pillerit) eivät vähentäneet Cervarixin suojatehoa.
Kerro lääkärille, jos parhaillaan käytät, olet äskettäin käyttänyt tai saatat käyttää muita lääkkeitä tai olet äskettäin saanut toisen rokotteen.
Raskaus, imetys ja hedelmällisyys
Jos olet raskaana, tulet raskaaksi Cervarix-rokotussarjan aikana tai jos yrität tulla raskaaksi, on suositeltavaa siirtää tai keskeyttää rokotukset, kunnes raskaus on päättynyt.
Jos olet raskaana tai imetät, epäilet olevasi raskaana tai jos suunnittelet lapsen hankkimista, kysy lääkäriltä neuvoa ennen kuin saat tämän rokotteen.
Ajaminen ja koneidenkäyttö
On epätodennäköistä, että Cervarix vaikuttaisi ajokykyyn tai koneidenkäyttökykyyn. Älä kuitenkaan aja autoa tai käytä koneita, jos tunnet itsesi huonovointiseksi.
Cervarix sisältää natriumkloridia
Tämä lääkevalmiste sisältää alle 1 mmol natriumia (23 mg) per annos eli sen voidaan sanoa olevan ”natriumiton”.
Miten valmistetta käytetään
Miten rokote annetaan
Lääkäri tai terveydenhoitaja pistää Cervarixin injektiona yläkäsivarren lihakseen.
Paljonko annetaan
Cervarix on tarkoitettu käyttöön 9 vuoden iästä alkaen.
Rokoteannosten määrä riippuu iästäsi ensimmäistä injektiota annettaessa:
Jos olet 9−14-vuotias
Saat 2 rokoteannosta:
ensimmäinen rokoteannos: valittuna ajankohtana
toinen rokoteannos: annetaan 5-13 kuukautta ensimmäisen annoksen jälkeen
Jos olet 15-vuotias tai vanhempi
Saat 3 rokoteannosta:
ensimmäinen rokoteannos: valittuna ajankohtana
toinen rokoteannos: 1 kuukausi ensimmäisen injektion jälkeen
kolmas rokoteannos: 6 kuukautta ensimmäisen injektion jälkeen
Tarvittaessa aikataulusta voidaan joustaa. Kysy lääkäriltä lisää neuvoja.
Rokotussarja suositellaan saatettavaksi loppuun Cervarixilla (eikä toisella HPV-rokotteella), jos ensimmäinen rokotus on annettu Cervarixilla.
Cervarixia ei suositella alle 9-vuotiaille.
Rokotetta ei saa milloinkaan antaa suoneen.
Jos annos jää antamatta
On tärkeää, että noudatat lääkärin tai sairaanhoitajan ohjeita uusintakäynneistä. Kysy lääkäriltä neuvoja, jos unohdat uusintakäynnin.
Paras vaste voi jäädä saavuttamatta, jos kaikkia rokotussarjan rokotuksia (kahta tai kolmea rokoteannosta riippuen iästäsi) ei anneta.
Mahdolliset haittavaikutukset
Kuten kaikki lääkkeet, tämäkin rokote voi aiheuttaa haittavaikutuksia. Kaikki eivät kuitenkaan niitä saa.
Haittavaikutuksia, joita on esiintynyt Cervarixin kliinisissä tutkimuksissa:
Hyvin yleisiä (useammin kuin kerran 10 rokoteannoksen jälkeen): kipu tai epämiellyttävä tunne injektiokohdassa, punoitus tai turvotus injektiokohdassa, päänsärky, lihassärky, lihasherkkyys tai lihasheikkous, jotka eivät johdu liikunnasta, väsymys.
Yleisiä (harvemmin kuin kerran 10 rokoteannoksen jälkeen, mutta useammin kuin kerran 100 rokoteannoksen jälkeen): maha-suolikanavan oireet, kuten pahoinvointi, oksentelu, ripuli ja vatsakipu, kutina, punoittava ihottuma, nokkosihottuma (urtikaria), nivelkipu, kuume (≥ 38 ºC).
Melko harvinaisia (harvemmin kuin kerran 100 rokoteannoksen jälkeen, mutta useammin kuin kerran 1000 rokoteannoksen jälkeen): ylähengitystieinfektio (nenän, kurkun tai henkitorven infektio), huimaus, muut reaktiot injektiokohdassa, kuten kovettuma, pistely tai puutuminen.
Näitä haittavaikutuksia on raportoitu Cervarixin markkinoille tulon jälkeen:
- allergiset reaktiot, joiden tunnusmerkkejä ovat:
- kutiseva ihottuma käsissä ja raajoissa
- silmien ja kasvojen turvotus
- hengitys- ja nielemisvaikeudet
- verenpaineen äkillinen lasku ja tajunnanmenetys
Nämä reaktiot ilmaantuvat yleensä ennen vastaanotolta poistumista. Ota heti yhteyttä lääkäriin, jos lapsesi saa jonkin näistä oireista.
- rauhasten turpoaminen kaulan alueella, kainalokuopassa tai nivusissa
- pyörtyminen, johon on joskus liittynyt tärinää tai jäykkyyttä.
Haittavaikutuksista ilmoittaminen
Jos havaitset haittavaikutuksia, kerro niistä lääkärille tai apteekkihenkilökunnalle. Tämä koskee myös sellaisia mahdollisia haittavaikutuksia, joita ei ole mainittu tässä pakkausselosteessa. Voit ilmoittaa haittavaikutuksista myös suoraan (ks. yhteystiedot alla). Ilmoittamalla haittavaikutuksista voit auttaa
saamaan enemmän tietoa tämän lääkevalmisteen turvallisuudesta.
www-sivusto: www.fimea.fi
Lääkealan turvallisuus- ja kehittämiskeskus Fimea
Lääkkeiden haittavaikutusrekisteri
PL 55
00034 FIMEA
Valmisteen säilyttäminen
Ei lasten ulottuville eikä näkyville.
Älä käytä tätä rokotetta pakkauksessa mainitun viimeisen käyttöpäivämäärän jälkeen. Viimeinen käyttöpäivämäärä tarkoittaa kuukauden viimeistä päivää.
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytettävä alkuperäispakkauksessa. Herkkä valolle.
Lääkkeitä ei pidä heittää viemäriin, eikä hävittää talousjätteiden mukana. Kysy käyttämättömien lääkkeiden hävittämisestä apteekista. Näin menetellen suojelet luontoa.
Pakkauksen sisältö ja muuta tietoa
Mitä Cervarix sisältää
- Vaikuttavat aineet ovat:
Ihmisen papilloomavirustyypin1 16 L1-proteiinia2,3,4 20 mikrogrammaa
Ihmisen papilloomavirustyypin1 18 L1-proteiinia2,3,4 20 mikrogrammaa
1Ihmisen papilloomavirus = HPV
2AS04-adjuvantti, joka sisältää:
3-O-desasyyli-4’-monofosforyylilipidi A:ta (MPL)3 50 mikrogrammaa
3adsorboituna alumiinihydroksidiin, hydratoituun (Al(OH)3) tot. 0,5 milligrammaa Al3+
4L1-proteiini viruksen kaltaisessa (ei infektiota aiheuttava) hiukkasmuodossa (VLP), joka on valmistettu rekombinantti-DNA-tekniikalla baculovirusekspressiosysteemissä. Tämä systeemi käyttää Trichoplusia ni -hyönteisestä saatuja Hi-5 Rix4446 -soluja. - Muut aineosat ovat natriumkloridi (NaCl), natriumdivetyfosfaattidihydraatti (NaH2PO4.2H2O) ja injektionesteisiin käytettävä vesi.
Lääkevalmisteen kuvaus ja pakkauskoko (-koot)
Injektioneste, suspensio esitäytetyssä ruiskussa.
Cervarix on samea, valkoinen suspensio.
Cervarix on saatavana yhden annoksen esitäytetyssä ruiskussa, neuloilla tai ilman erillisiä neuloja, pakkauskoot 1 ja 10.
Kaikki pakkauskoot eivät välttämättä ole markkinoilla.
Myyntiluvan haltija ja valmistaja
GlaxoSmithKline Biologicals s.a.
Rue de l’Institut 89
B-1330 Rixensart
Belgia
Lisätietoja tästä lääkevalmisteesta antaa myyntiluvan haltijan paikallinen edustaja:
Suomi/Finland
GlaxoSmithKline Oy
Puh/Tel: + 358 10 30 30 30
Tämä pakkausseloste on tarkistettu viimeksi 04/2023
Muut tiedonlähteet
Lisätietoa tästä lääkevalmisteesta on saatavilla Euroopan lääkeviraston verkkosivuilta http://www.ema.europa.eu.
Ohjeet terveydenhuollon ammattilaiselle
Cervarix tulee antaa niin pian kuin mahdollista sen jälkeen, kun rokote on otettu jääkaapista. Säilyvyystutkimustulokset osoittavat kuitenkin, että säilytettynä jääkaapin ulkopuolella Cervarixon käyttökelpoinen korkeintaan kolme vuorokautta 8 °C - 25 °C:ssa tai korkeintaan yhden vuorokauden 25 °C - 37 °C:ssa säilytettynä. Rokote pitää hävittää, jos sitä ei käytetä tämän ajan kuluessa.
Säilytyksen aikana voi muodostua hienojakoinen valkoinen sakka ja kirkas väritön pintakerros. Tämä ei ole laadun huononemisen merkki.
Rokote on tarkistettava silmämääräisesti ennen ja jälkeen ravistamisen mahdollisten vierashiukkasten havaitsemiseksi ja/tai fysikaalisten muutosten varalta. Rokotetta ei saa käyttää, jos ulkonäössä havaitaan muutoksia.
Rokotetta on ravistettava hyvin ennen käyttöä.
Esitäytetyn ruiskun käyttöohje
|
|
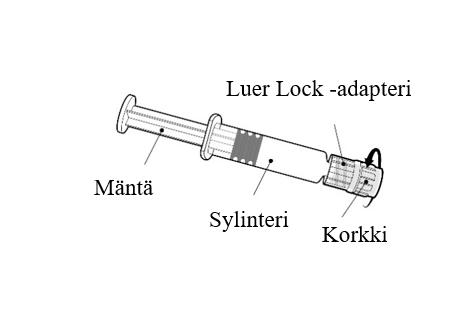
Pidä kiinni ruiskun sylinteristä, ei männästä. Poista ruiskun korkki kiertämällä vastapäivään. |
|
|
Neula kiinnitetään ruiskuun yhdistämällä neulan kanta Luer Lock -adapteriin ja kiertämällä neulaa neljänneskierros myötäpäivään, kunnes neula tuntuu kiinnittyvän ruiskuun. Korkki Älä vedä ruiskun mäntää ulos sylinteristä. Jos mäntä irtoaa sylinteristä, älä anna rokotetta. |
Hävitys
Käyttämätön lääkevalmiste tai jäte on hävitettävä paikallisten vaatimusten mukaan.