Pakkausseloste
BRAVECTO injektiokuiva-aine ja liuotin, suspensiota varten 150 mg/ml
ELÄINLÄÄKEVALMISTEEN NIMI
Bravecto 150 mg/ml injektiokuiva-aine ja liuotin, suspensiota varten koiralle
VAIKUTTAVAT JA MUUT AINEET
| Kuiva-ainepullo: |
Liuotinpullo: |
Käyttökuntoon saatettu suspensio: |
| Yksi pullo sisältää: Vaikuttava aine: fluralaneeri 2,51 g |
Yksi ml sisältää: Apuaineet: bentsyylialkoholi 22,3 mg |
Yksi ml sisältää: Vaikuttava aine: fluralaneeri 150 mg Apuaineet: bentsyylialkoholi 20 mg |
| Valkoinen tai vaaleankeltainen kuiva-aine. |
Kirkas tai läpikuultamaton viskoosi liuos. |
Läpikuultamaton, valkoinen tai vaaleankeltainen ja hieman viskoosi suspensio. |
KÄYTTÖAIHEET
Puutiais- ja kirpputartuntojen hoito koiralla.
Tämä eläinlääke on systeemisesti vaikuttava insektisidinen ja akarisidinen aine, jolla on:
- välitön ja pitkäkestoinen kirppuja (Ctenocephalides felis ja Ctenocephalides canis) tappava vaikutus 12 kuukauden ajan,
- pitkäkestoinen Ixodes ricinus -, Ixodes hexagonus - ja Dermacentor reticulatus -puutiaisia tappava vaikutus 12 kuukauden ajan alkaen kolmantena päivänä valmisteen annosta,
- pitkäkestoinen Rhipicephalus sanguineus -puutiaisia tappava vaikutus 12 kuukauden ajan alkaen neljäntenä päivänä valmisteen annosta.
Kirppujen ja puutiaisten täytyy kiinnittyä koiraan ja aloittaa imeminen, jotta ne altistuvat vaikuttavalle aineelle.
Eläinlääkettä voidaan käyttää osana kirppuallergian (flea allergy dermatitis, FAD) hoitoa.
Dermacentor reticulatus -puutiaisen välittämän Babesia canis canis -infektion riskin pienentäminen 12 kuukauden ajan alkaen kolmantena päivänä valmisteen annosta. Vaikutus on epäsuora ja johtuu eläinlääkkeen aktiivisuudesta vektoria vastaan.
Ctenocephalides felis -kirpun välittämän Dipylidium caninum -infektion riskin pienentäminen 12 kuukauden ajan. Vaikutus on epäsuora ja johtuu eläinlääkkeen aktiivisuudesta vektoria vastaan.
VASTA-AIHEET
Ei saa käyttää tapauksissa, joissa esiintyy yliherkkyyttä vaikuttavalle aineelle tai apuaineille.
HAITTAVAIKUTUKSET
Koira:
| Yleinen (1–10 eläintä 100 hoidetusta eläimestä): |
| Turvotus pistoskohdassa1 |
| Melko harvinainen (1–10 eläintä 1 000 hoidetusta eläimestä): |
| Ruokahalun väheneminen, väsymys, verekkäät limakalvot |
| Hyvin harvinainen (< 1 eläin 10 000 hoidetusta eläimestä, yksittäiset ilmoitukset mukaan luettuina): |
| Lihasvapina, ataksia (vaikeus koordinoida liikkeitä), kouristus |
1Tunnusteltavissa ja/tai näkyvissä olevia turvotuksia, ei tulehduksellisia, ei kivuliaita, ajan myötä itsestään paranevia.
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeen turvallisuuden jatkuvan seurannan. Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita ensisijaisesti asiasta eläinlääkärillesi. Voit ilmoittaa kaikista haittavaikutuksista myös myyntiluvan haltijalle käyttämällä tämän pakkausselosteen lopussa olevia yhteystietoja tai kansallisen ilmoitusjärjestelmän kautta:
Lääkealan turvallisuus- ja kehittämiskeskus Fimea www-sivusto: https://fimea.fi/elainlaakkeet
KOHDE-ELÄINLAJI
Koira
ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Ihon alle.
Annostele 0,1 ml käyttökuntoon saatettua suspensiota painokiloa kohti (vastaten 15 mg fluralaneeria painokiloa kohti) ihon alle, esim. koiran lapaluiden väliin (dorso-skapulaarialue). Koira on punnittava annosteluhetkellä tarkan annoksen laskemiseksi.
Aliannostus voi johtaa tehottomaan käyttöön ja edistää resistenssin kehittymistä.
Seuraavaa taulukkoa voi käyttää annosteluohjeena:
| Paino (kg) |
Käyttökuntoon saatetun suspension määrä (ml) |
| 5 |
0,5 |
| 10 |
1 |
| 15 |
1,5 |
| 20 |
2 |
| 25 |
2,5 |
| 30 |
3 |
| 35 |
3,5 |
| 40 |
4 |
| 45 |
4,5 |
| 50 |
5 |
| 55 |
5,5 |
| 60 |
6 |
Laske annos vastaavalla tavalla koirille, jotka painavat alle 5 kg tai yli 60 kg.
ANNOSTUSOHJEET
Suspension saattaminen käyttökuntoon ennen ensimmäistä käyttökertaa:
Yksi pullo injektiokuiva-ainetta liuotetaan 15 ml:lla liuotinta. On suositeltavaa käyttää 18 G:n steriiliä siirtoneulaa ja steriiliä 20 ml:n ruiskua valmisteen käyttökuntoon saattamisessa.
- Ravista fluralaneerikuiva-ainepulloa mahdollisten kuiva-ainekasaumien hajottamiseksi ennen valmisteen käyttökuntoon saattamista.
- Kääntele liuotinpulloa ylösalaisin ainakin 3 kertaa, kunnes sen sisältö on silmin nähden tasaista.
- Injektoi ensin enintään 14 ml ilmaa liuotinpulloon ja vedä sitten pullosta 15 ml liuotinta (kuva A). Pullossa on enemmän liuotinta kuin valmisteen käyttökuntoon saattamiseen tarvitaan. Hävitä pullo ja sinne jäänyt ylimääräinen liuotin.
- Lävistä fluralaneerikuiva-ainepullon tulppa 25 G:n ilmausneulalla (kuva B).
- Siirrä 15 ml liuotinta hitaasti fluralaneerikuiva-ainetta sisältävään pulloon samalla, kun kierität pulloa kädessäsi vaakatasossa, siten, että kuiva-aine kostuu täysin (kuva C).
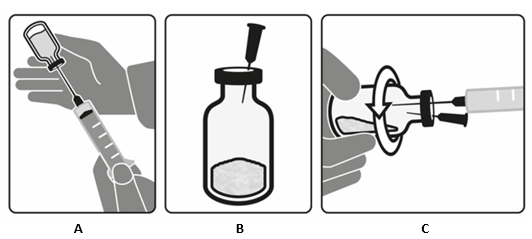
- Kun liuotin on lisätty, poista ilmausneula ja liuottimen siirtoneula fluralaneerikuiva-ainepullosta. Hävitä neulat.
- Ravista pulloa voimakkaasti vähintään 30 sekunnin ajan, kunnes muodostuu täysin sekoittunut suspensio. Käyttökuntoon saatettu valmiste on läpikuultamaton, väriltään valkoinen tai vaaleankeltainen ja hieman viskoosi suspensio, jossa ei käytännössä näy kasaumia.
- Lasipullon etikettiin merkitty viimeinen käyttöpäivä viittaa sekoittamattoman kuiva-aineen kestoaikaan. Käyttökuntoon saattamisen jälkeen suspensio on hävitettävä 3 kuukauden kuluessa siitä päivästä, kun valmiste on saatettu käyttökuntoon. Kirjoita hävityspäivä lasipullon etikettiin.
Käyttökuntoon saatetun suspension annostelu koiralle:
- Määritä annosteltava annos koiran painon perusteella.
- Käytä steriiliä ruiskua ja steriiliä 18 G:n neulaa annosteluun.
- Fluralaneerikuiva-aine erottuu suspensiosta sen seistessä paikallaan. Ravista käyttökuntoon saatettua pulloa voimakkaasti 30 sekunnin ajan ennen jokaista käyttökertaa saadaksesi aikaan tasalaatuisen suspension.
- Ilman injisoiminen pulloon ennen annostelua voi olla tarpeen.
- Annos on annettava noin 5 minuutin kuluessa siitä, kun se on vedetty annosteluruiskuun. Näin voidaan varmistaa sekä suspension pysyminen tasalaatuisena että suspension tarkka annostelu.
- Injisoi valmiste ihonalaisesti, esim. lapaluiden väliin selän puolelle (dorso-skapulaarialue).
Älä lävistä käyttökuntoon saatettua liuosta sisältävän pullon tulppaa enempää kuin 20 kertaa. Saattaaksesi valmisteen uudelleen käyttökuntoon sen asettumisen jälkeen ravista pulloa voimakkaasti vähintään 30 sekunnin ajan, jotta saat tasalaatuisen suspension.
Hoito-ohjelma
Kirppu- ja puutiaistartuntojen osalta uusintahoidon tarpeen ja tiheyden olisi perustuttava ammattilaisen neuvoihin ja siinä tulisi huomioida paikallinen epidemiologinen tilanne ja eläimen elinolosuhteet. Tällä eläinlääkkeellä hoito voidaan aloittaa mihin tahansa aikaan vuodesta ja hoitoa voidaan jatkaa keskeytyksettä. Katso myös kohta ”Erityisvaroitukset”.
VAROAIKA
Ei oleellinen.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville.
Tämä eläinlääke ei avaamattomana vaadi lämpötilan suhteen erityisiä säilytysolosuhteita.
Käyttökuntoon saattamisen jälkeen säilytä alle 30 °C.
Älä käytä tätä eläinlääkettä viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu etiketissä merkinnän Exp. jälkeen. Viimeisellä käyttöpäivämäärällä tarkoitetaan kuukauden viimeistä päivää.
Ohjeiden mukaan käyttökuntoon saatetun eläinlääkkeen kestoaika: 3 kuukautta.
ERITYISVAROITUKSET
Erityisvaroitukset:
Ulkoloisten täytyy kiinnittyä koiraan ja aloittaa imeminen, jotta ne altistuvat fluralaneerille. Tämän vuoksi ulkoloisvälitteisten tautien (mukaan lukien Babesia canis canis ja D. caninum) tartuntariskiä ei voida sulkea kokonaan pois.
Loislääkkeiden tarpeeton tai valmisteyhteenvedon ohjeista poikkeava käyttö voi lisätä resistenssin valintapainetta ja johtaa tehon heikkenemiseen. Eläinlääkkeen käyttöä koskevan päätöksen tulisi kunkin yksittäisen eläimen osalta perustua loislajien ja loistaakan tai epidemiologisen tilanteen mukaisen tartuntariskin varmistamiseen (ottaen huomioon, että valmisteen vaikutus kestää 12 kuukautta).
On otettava huomioon mahdollisuus, että saman kotitalouden muut eläimet voivat olla ulkoloisten uudelleentartunnan lähde, ja muut eläimet on hoidettava tarpeen mukaan asianmukaisella eläinlääkkeellä.
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:
Tämän eläinlääkkeen turvallisuutta ei ole arvioitu koirilla, joilla on aiemmin todettu epilepsia. Tästä syystä tätä eläinlääkettä on käytettävä varoen tällaisilla koirilla perustuen eläinlääkärin tekemään hyöty-riskiarvioon.
Koska tietoja ei ole saatavilla, valmistetta ei pidä käyttää alle 6 kuukauden ikäisille koirille.
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Ihmisillä on raportoitu fluralaneeriin tai bentsyylialkoholiin liittyviä yliherkkyysreaktioita, jotka voivat olla vakavia. Myös pistoskohdan reaktioita voi ilmetä. Tätä eläinlääkettä annosteltaessa on noudatettava varovaisuutta, jotta lääkkeen antaja ei vahingossa injisoisi itseään ja ettei ihoaltistusta tapahtuisi. Jos vahingossa injisoit itseesi valmistetta ja sinulla ilmenee haittavaikutuksia, yliherkkyysreaktioita tai pistoskohdan reaktioita, käänny lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys. Pese kädet käytön jälkeen.
Tätä eläinlääkettä saa annostella vain eläinlääkäri tai annostelun tulee tapahtua eläinlääkärin välittömässä valvonnassa.
Tiineys ja laktaatio:
Tämän eläinlääkkeen turvallisuutta tiineyden ja laktaation aikana ei ole selvitetty.
Käytä vain eläinlääkärin tekemän hyöty-riskiarvion mukaisesti.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Fluralaneeri sitoutuu voimakkaasti plasman proteiineihin ja voi kilpailla muiden voimakkaasti sitoutuvien lääkeaineiden kanssa, kuten ei-steroidiset tulehduskipulääkkeet (NSAID) tai kumariinijohdannainen varfariini. Fluralaneerin inkubointi oletetulla maksimikonsentraatiolla koiran plasmassa karprofeenin tai varfariinin kanssa ei vähentänyt fluralaneerin, karprofeenin tai varfariinin sitoutumista plasman proteiineihin.
Kliinisten kenttäkokeiden aikana ei havaittu yhteisvaikutuksia tämän eläinlääkkeen ja muiden yleisesti käytettävien eläinlääkkeiden (mukaan lukien rokotteet) kanssa.
Yliannostus:
Kun fluralaneeria annosteltiin ihonalaisesti 6 kuukauden ikäisille koiranpennuille kolmin- ja viisinkertainen määrä suositeltuun annokseen (15 mg fluralaneeria / paino kg) nähden joka neljäs kuukausi ja kaikkiaan 6 annosta (päivät 1, 120, 239, 358, 477 ja 596), ainoa hoitoon liittyvä löydös oli pistoskohdan turvotus, joka hävisi ajan myötä.
Vaikuttavana aineena toimiva fluralaneeri oli hyvin siedetty Collie-rotuisilla koirilla, joilla oli MDR1-geenimuunnos (MDR1-/-), kun annettiin kolminkertainen suositeltu enimmäisannos (168 mg/ paino kg) kerta-annoksena suun kautta. Koska systeeminen enimmäisaltistus fluralaneerille ihonalaisen annostelun jälkeen ei ole suurempi verrattuna suun kautta tapahtuvaan annosteluun, tämän ihonalaisesti injisoitavan eläinlääkkeen katsotaan olevan turvallinen MDR1(-/-) koirilla.
Merkittävät yhteensopimattomuudet:
Koska yhteensopimattomuustutkimuksia ei ole tehty, eläinlääkettä ei saa sekoittaa muiden eläinlääkkeiden kanssa.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkettä ei saa joutua vesistöihin, sillä fluralaneeri saattaa vahingoittaa vesieliöitä.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia kansallisia keräysjärjestelmiä. Näiden toimenpiteiden avulla voidaan suojella ympäristöä.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
8.1.2024
Tätä eläinlääkettä koskevaa yksityiskohtaista tietoa on saatavilla unionin valmistetietokannassa (https://medicines.health.europa.eu/veterinary ).
MUUT TIEDOT
Eläinlääke säätelee koiran elinympäristön kirppupopulaatioita koiran elinalueella.
Koiraan jo ennen tämän eläinlääkkeen annostelua tarttuneet I. ricinus - ja D. reticulatus -puutiaiset kuolevat 72 tunnin sisällä. Koiraan jo ennen tämän eläinlääkkeen annostelua tarttuneet R. sanguineus -puutiaiset kuolevat 96 tunnin sisällä. Vasta kiinnittyneiden puutiaisten on osoitettu kuolevan 48 tunnin sisällä alkaen hoidon jälkeisestä ensimmäisestä viikosta aina 12 kuukauteen asti.
Koiraan jo ennen tämän eläinlääkkeen annostelua tarttuneet kirput kuolevat 48 tunnin sisällä. Vasta kiinnittyneiden kirppujen on osoitettu kuolevan 24 tunnin sisällä alkaen hoidon jälkeisestä ensimmäisestä viikosta aina 12 kuukauteen asti.

mix.bravecto.com
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija ja yhteystiedot epäillyistä haittatapahtumista ilmoittamista varten:
Intervet International B.V., Wim de Körverstraat 35, 5831 AN Boxmeer, Alankomaat
Suomi
Puh: + 358 10 2310 750
Erän vapauttamisesta vastaava valmistaja:
Vet Pharma Friesoythe GmbH, Sedelsberger Strasse 2–4, 26169 Friesoythe, Saksa