Pakkausseloste
EQUILIS PREQUENZA injektioneste, suspensio
ELÄINLÄÄKEVALMISTEEN NIMI
Equilis Prequenza injektioneste, suspensio hevoselle
VAIKUTTAVAT JA MUUT AINEET
Yksi annos (1 ml) sisältää:
Vaikuttavat aineet
Hevosen influenssaviruskannat:
A/equine-2/ South Africa/4/03 50 AU1
A/equine-2/ Newmarket/2/93 50 AU
1 ELISA-antigeeniyksikköä
Adjuvantit
Iscom-matrix sisältäen:
Puhdistettu saponiini 375 µg
Kolesteroli 125 µg
Fosfatidyylikoliini 62,5 µg
Kirkas opaalinhohtoinen suspensio.
KÄYTTÖAIHEET
Hevosten aktiivinen immunisointi 6 kuukauden iästä lähtien hevosinfluenssaa vastaan vähentämään kliinisiä oireita ja viruseritystä tartunnan jälkeen.
Immuniteetin kehittyminen: 2 viikkoa perusrokotusten jälkeen
Immuniteetin kesto: 5 kuukautta perusrokotusten jälkeen
1 vuosi 1. tehosterokotuksen jälkeen
VASTA-AIHEET
Ei ole.
HAITTAVAIKUTUKSET
Hevonen:
Harvinainen (1–10 eläintä 10 000 hoidetusta eläimestä): | Injektiokohdan turvotus1, Injektiokohdan kipu2. |
Hyvin harvinainen (< 1 eläin 10 000 hoidetusta eläimestä, yksittäiset ilmoitukset mukaan luettuina): | Kuume3, Voimakas väsymys3, Ruokahaluttomuus3, Yliherkkyysreaktiot4. |
1 Epätarkkarajaista kovaa tai pehmeää turvotusta (halkaisijaltaan korkeintaan 5 cm), joka häviää kahden päivän kuluessa. Hyvin harvinaisissa tapauksissa paikallinen reaktio voi olla yli 5 cm halkaisijaltaan ja mahdollisesti kestää kauemmin kuin 2 vuorokautta.
2 Kipu injektiokohdassa voi aiheuttaa ohimenevää toiminnallista epämukavuutta (jäykkyyttä).
3 Kuume, johon joskus liittyy voimakasta väsymystä tai ruokahaluttomuutta voi esiintyä vuorokauden ajan ja poikkeustapauksissa se voi kestää korkeintaan 3 vuorokautta.
4 Mukaan lukien anafylaksia (joskus kohtalokasta). Jos tällainen reaktio ilmenee, asianmukainen hoito on aloitettava viipymättä.
Haittatapahtumista ilmoittaminen on tärkeää. Se mahdollistaa eläinlääkkeen turvallisuuden jatkuvan seurannan. Jos havaitset haittavaikutuksia, myös sellaisia, joita ei ole mainittu tässä pakkausselosteessa, tai olet sitä mieltä, että lääke ei ole tehonnut, ilmoita ensisijaisesti asiasta eläinlääkärillesi. Voit ilmoittaa kaikista haittavaikutuksista myös myyntiluvan haltijalle käyttämällä tämän pakkausselosteen lopussa olevia yhteystietoja tai kansallisen ilmoitusjärjestelmän kautta:
Lääkealan turvallisuus- ja kehittämiskeskus Fimea www-sivusto: https://www.fimea.fi/elainlaakkeet/
KOHDE-ELÄINLAJI
Hevonen
ANNOSTUS, ANTOREITIT JA ANTOTAVAT KOHDE-ELÄINLAJEITTAIN
Yksi annos (1 ml). Lihakseen.
Rokotusohjelma:
Perusrokotukset
1 annos (1 ml) hevosta kohti injisoidaan lihakseen seuraavan rokotusohjelman mukaisesti:
· Perusrokotukset: ensimmäinen injektio 6 kuukauden iästä lähtien, toinen injektio 4 viikkoa myöhemmin
Tehosterokotus
On suositeltavaa, että tehosterokotus annetaan vain hevosille, jotka ovat saaneet perusrokotuksen samantyyppisiä hevosinfluenssaviruksia sisältävällä rokotteella. Perusrokotusten antaminen voi olla tarpeellista hevosille, joita ei ole perusrokotettu vastaavalla rokotteella.
Ensimmäinen tehosterokotus (kolmas annos) annetaan 5 kuukautta perusrokotusjakson jälkeen. Tämän tehosterokotuksen jälkeen immuniteetti hevosinfluenssaa vastaan säilyy vähintään 12 kuukautta.
Toinen tehosterokotus annetaan 12 kuukautta ensimmäisen tehosterokotuksen jälkeen.
Vaihtoehtoisesti voidaan 12 kuukauden välein käyttää jotakin muuta sopivaa hevosinfluenssarokotetta, joka sisältää kantoja A/equine-2/South Africa/4/03 ja A/equine 2/Newmarket-2/93 immuniteetin säilyttämiseksi influenssaa vastaan (ks. rokotuskaavio).
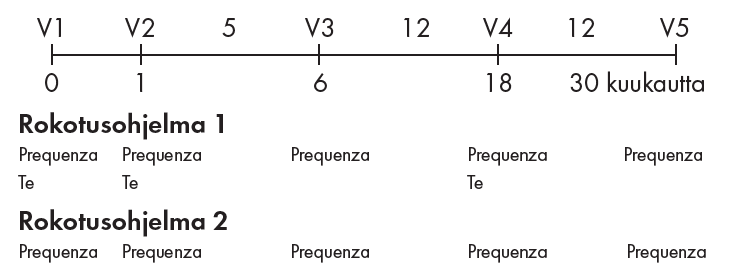
Jos infektioriski on lisääntynyt tai jos varsa ei ole saanut riittävästi ternimaitoa, voidaan lisäksi antaa ensimmäinen injektio 4 kuukauden iässä, minkä jälkeen rokotukset annetaan rokotusohjelman mukaisesti (perusrokotukset 6 kuukauden iässä ja 4 viikkoa myöhemmin).
ANNOSTUSOHJEET
Anna rokotteen lämmetä huoneenlämpöiseksi ennen käyttöä.
VAROAIKA
Nolla vrk.
SÄILYTYSOLOSUHTEET
Ei lasten näkyville eikä ulottuville.
Säilytä jääkaapissa (2 °C – 8 °C).
Ei saa jäätyä.
Säilytä valolta suojassa.
Älä käytä tätä eläinlääkettä viimeisen käyttöpäivämäärän jälkeen, joka on ilmoitettu etiketissä merkinnän Exp. jälkeen. Viimeisellä käyttöpäivämäärällä tarkoitetaan kuukauden viimeistä päivää.
ERITYISVAROITUKSET
Erityisvaroitukset:
Rokota vain terveitä eläimiä.
Erityiset varotoimet, jotka liittyvät turvalliseen käyttöön kohde-eläinlajilla:
Varsat suositellaan rokotettavaksi aikaisintaan 6 kuukauden ikäisinä, etenkin jos varsan emä on rokotettu uudelleen synnytystä edeltäneen kahden kuukauden aikana maternaalisten vasta-aineiden mahdollisen häiritsemisen vuoksi
Erityiset varotoimenpiteet, joita eläinlääkettä eläimille antavan henkilön on noudatettava:
Jos vahingossa injisoit itseesi valmistetta, käänny välittömästi lääkärin puoleen ja näytä hänelle pakkausseloste tai myyntipäällys.
Tiineys ja laktaatio:
Voidaan käyttää tiineyden ja imetyksen aikana.
Yhteisvaikutukset muiden lääkevalmisteiden kanssa sekä muut yhteisvaikutukset:
Rokotteen turvallisuudesta ja tehosta yhteiskäytössä muiden eläinlääkkeiden kanssa ei ole tietoa. Tästä syystä päätös rokotteen käytöstä ennen tai jälkeen muiden eläinlääkkeiden antoa on tehtävä tapauskohtaisesti
Yliannostus:
Kaksinkertaisen rokoteannoksen jälkeen ei ole havaittu muita haittavaikutuksia kuin kohdassa ”Haittatapahtumat” kuvatut lukuun ottamatta rokotuspäivänä ilmennyttä lievää alakuloisuutta.
Merkittävät yhteensopimattomuudet:
Ei saa sekoittaa muiden eläinlääkkeiden kanssa.
ERITYISET VAROTOIMET KÄYTTÄMÄTTÖMÄN VALMISTEEN TAI JÄTEMATERIAALIN HÄVITTÄMISEKSI
Lääkkeitä ei saa kaataa viemäriin eikä hävittää talousjätteiden mukana.
Eläinlääkkeiden tai niiden käytöstä syntyvien jätemateriaalien hävittämisessä käytetään paikallisia palauttamisjärjestelyjä sekä kyseessä olevaan eläinlääkkeeseen sovellettavia kansallisia keräysjärjestelmiä. Näiden toimenpiteiden avulla voidaan suojella ympäristöä.
Kysy käyttämättömien lääkkeiden hävittämisestä eläinlääkäriltäsi tai apteekista.
PÄIVÄMÄÄRÄ, JOLLOIN PAKKAUSSELOSTE ON VIIMEKSI HYVÄKSYTTY
07/2023
Tätä eläinlääkettä koskevaa yksityiskohtaista tietoa on saatavilla unionin valmistetietokannassa (https://medicines.health.europa.eu/veterinary).
MUUT TIEDOT
Eläinlääkkeiden luokittelu
Reseptivalmiste.
Myyntilupien numerot ja pakkauskoot
EU/2/05/056/001–004
Pakkauskoot:
Pahvipakkaus, jossa on 10 lasista 1 ml:n injektiopulloa (1 annos).
Pahvipakkaus, jossa on 1, 5 tai 10 esitäytettyä 1 ml:n (1 annos) ruiskua neuloineen.
Kaikkia pakkauskokoja ei välttämättä ole markkinoilla.
MYYNTILUVAN HALTIJAN NIMI JA OSOITE SEKÄ ERÄN VAPAUTTAMISESTA VASTAAVAN VALMISTAJAN NIMI JA OSOITE EUROOPAN TALOUSALUEELLA, JOS ERI
Myyntiluvan haltija ja erän vapauttamisesta vastaava valmistaja ja yhteystiedot epäillyistä haittatapahtumista ilmoittamista varten:
Intervet International B.V., Wim de Körverstraat 35,5831 AN Boxmeer, Alankomaat
Suomi
Puh: + 358 10 2310 750